抗原提呈细胞的成熟(识别)、T细胞活化、增殖(活化)以及T细胞免疫应答(效应)是治疗性肿瘤疫苗的三个关键阶段。其中免疫佐剂在这三种过程中发挥极其重要的作用。机体受自然界病原体感染后能够唤起强烈的免疫应答。因此“仿病原体”疫苗在细胞免疫抗肿瘤研究方面提供一种实际可行的研究策略。
受此启发,苏州大学软凝聚态物理及交叉研究中心张卫东副教授等在前期研究中发现天然葡聚糖改性的CpG佐剂,在小鼠E.G7肿瘤疫苗模型里,通过激发自身免疫系统,血液中六分之一的T细胞都是肿瘤抗原特异性CD8+T细胞,50%的小鼠可以完全治愈肿瘤(图1, Bioconjugate Chem. 2017, 28, 1993)。

图1 糖疫苗抑瘤效果: abd)免疫接种后小鼠体内特异性CD8+T细胞的增殖情况。c)E.G7肿瘤模型的抑瘤曲线。e)接种70天后记忆性CD8+T细胞的比例。
未成熟的抗原提呈细胞(如树突状细胞和巨噬细胞)表面有多种模式识别受体(如CLR和TLR)。在前期工作基础上,本研究工作结合该研究团队开发的光诱导RAFT聚合(ACS Macro Letters. 2016, 5, 1278)和多巴胺化学,进一步发展一种绿色合成“仿病原体”疫苗的策略:即利用光诱导RAFT聚合对邻苯二酚基团的耐受性,可控设计合成了含有邻苯二酚和糖基团的共聚物,利用邻苯二酚基团易氧化和高反应活性的特点,原位制备糖包裹的金纳米粒子,同时将巯基功能化的免疫佐剂偶联到金纳米粒子,可控设计合成了含有glucose和CpG的糖佐剂@Au纳米粒子。体外RAW-blue细胞实验表明糖佐剂@Au纳米粒子作为危险信号可以提高佐剂的活性。
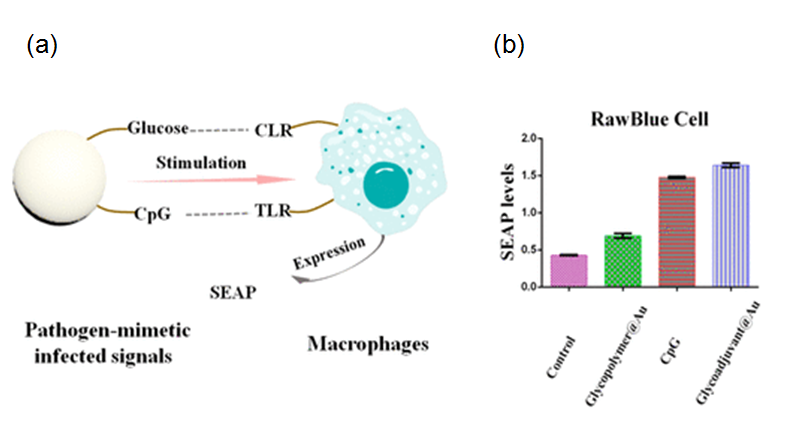
图2 糖疫苗抑瘤效果: a)免疫佐剂刺激抗原提呈细胞示意图。b)刺激后Raw-blue细胞SEAP表达情况。
相关工作已发表在ACS Macro Letters. 2018, 7, 70上。论文的第一作者为苏州大学硕士生文明,共同通讯作者为苏州大学陈高健教授与苏州大学张卫东副教授。
论文链接:http://pubs.acs.org/doi/full/10.1021/acsmacrolett.7b00837
- 福建师大杨震/张先增、西工大黄维 Adv. Sci.:极化调控与界面缺陷工程协同增强光-热释电效应 - 助力肿瘤治疗 2026-03-01
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 山东大学崔基炜教授团队《Adv. Mater.》:“以瘤治瘤”的水凝胶疫苗 - 实现个性化肿瘤免疫治疗新突破 2025-10-09
- 安徽中医药大学沈伟、尹登科团队 ACS Nano:新型溶瘤水凝胶 - 通过产生原位疫苗、重塑肿瘤物理和代谢屏障增强免疫检查点阻断 2025-09-18
