恶性肿瘤严重威胁人类生命健康,肿瘤协同治疗利用多种治疗手段,可以增强疗效、减少毒副作用。其中,光热治疗、热动力治疗及化疗的协同策略构成了典型协同组合。光热治疗通过局部加热迅速杀伤肿瘤细胞,但治疗时间短(5-20分钟),长期治疗会造成局部过热而破坏正常组织;热动力疗法利用活性氧杀伤肿瘤细胞,治疗时间可维持数小时;化疗虽广谱高效,但毒性较强,且需20小时以上才能达到有效药物治疗浓度并且继续维持20-48小时。因此,上述协同治疗策略可以使多种疗法的优势互补,已成为肿瘤协同治疗的重要研究方向。然而,上述策略仍面临两大挑战:一是光热治疗受限于近红外光穿透浅、加热不均,导致深层肿瘤难以彻底清除。由于表面过热和组织损伤,24小时内无法再次治疗;二是多种治疗手段随时间强度上难以协调,简单的疗法叠加和经验式的治疗功率/剂量设定容易造成治疗间隙,导致治疗强度随时间呈“峰谷式”波动,使肿瘤细胞耐受增强,削弱了整体疗效。治疗剂量和药物浓度不仅有较大浪费,还会造成对正常组织的毒副作用,不能充分发挥光热治疗、热动力治疗及化疗的协同治疗优势。解决上述问题需开发具有深部穿透能力的光疗设备和精确控释能力的多药递送系统以确保多模态协同疗法在强度和时序上的协调统一。
近期,西安交通大学生命学院吴道澄教授团队研发了光疗微针(PMN)系统,大幅度增加了穿透深度,实现了连续光疗。提出了一种连续高强度光热-热动力交替循环治疗及化疗的肿瘤协同治疗新策略。该策略以肿瘤细胞死亡率作为比较和统一各治疗手段强度的标准,将能诱导≥90%细胞死亡的光热温度、自由基浓度与化疗剂量定义为高强度治疗阈值。基于此,构建了一个持续48小时高强度协同治疗策略:前20小时内进行3次光热治疗(每次10分钟),其间激活热动力剂产生自由基,实现光热-热动力交替治疗;20小时后,化疗药物浓度达高强度阈值,进入长达28小时的持续双药化疗阶段,从而实现了48小时连续高强度的抗肿瘤治疗(图1)。达到了高效、低剂量和低能量的肿瘤综合治疗效果。

图1. 肿瘤连续高强度光热-热动力交替循环治疗及化疗策略示意图。(A)复合纳米粒Dp825:ARS@PDA-Fe(III)-FA ICP NCPs制备;(B) PMN与光学透镜性能比较;(C)为比较和统一各治疗手段强度建立以肿瘤细胞死亡率为标准的衡量关系;(D)持续高强度光热-热动力交替治疗及化疗期间复合纳米粒和肿瘤细胞状变化。
为实现该策略,研究团队设计了一种光疗微针(PMN)系统,将光纤穿过多孔不锈钢微针,使激光通过微针直接到达肿瘤组织。该系统可将能量精准传导至肿瘤核心,降低对周围正常组织的热损伤风险,支持更长时间和多周期的光热-热动力协同治疗,实验表明PMN的穿透深度是传统透镜的20倍,仅需1/5的激光功率即可达到相同治疗温度,并能在30分钟内维持温度稳定,显示出良好的可控性与应用潜力(图2),克服了现有光疗系统的困难。
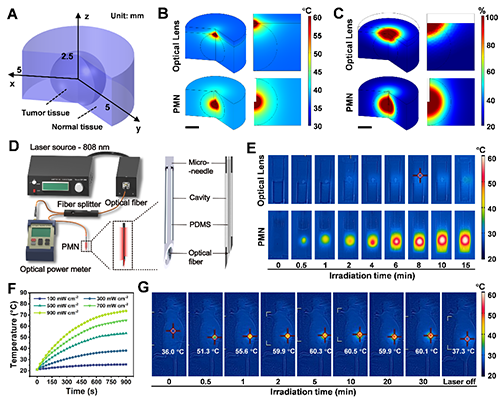
图2. 光疗微针(PMN)的仿真和实验验证。(A)双层肿瘤组织模型;(B)光学透镜和PMN照射的肿瘤组织温度分布;(C)光学透镜和PMN照射的肿瘤组织热损伤;(D) PMN系统结构示意图;(E)光学透镜和PMN照射凝胶的红外热像图;(F) PMN照射凝胶温度变化;(G)PMN照射小鼠肿瘤部位的红外热像图。
此外,团队设计了一种双层复合纳米粒(Dp825:ARS@PDA-Fe(Ⅲ)-FA ICP NCPs,缩写为NCPs),以盐酸阿霉素(DOX)和光热剂IR825通过分子堆砌形成核心纳米粒(Dp825 NPs),外层包覆以聚多巴胺(PDA)、Fe(III)离子及叶酸(FA)构建的无限配位聚合物(ICP),同时负载热动力剂/化疗剂青蒿琥酯(ARS)。该NCPs具有肿瘤靶向性,外层ICP可在肿瘤微环境中酸性环境响应分解,按序释放各治疗剂,完成光热-热动力交替治疗,并持续释放化疗药物,在PMN辅助下实现48小时的连续高强度治疗,达到了多模态协同疗法在强度和时序上的协调统一。
NCPs结构如图3所示,动态光散射法测定核心纳米粒Dp825 NPs的粒径为7.17 ± 1.04 nm,经过ICP包覆后形成的最终复合纳米粒的粒径为111.9 ± 37.10 nm,且在4.0℃储存90天仍保持粒径稳定,展现出良好的稳定性。Zeta电位分析显示,Dp825 NPs带正电(+23.6 mV),在形成ICP壳层后转为近中性(-0.7 mV),有助于延长体内循环并减少非特异性吸附。紫外-可见吸收光谱显示NCPs在808 nm处吸收显著增强,并在900–950 nm波段出现新吸收峰,表明其光热转换性能提升。红外光谱证实了NCPs中各功能组分的成功组装,X射线衍射及X射线光电子能谱结果均证实了外层ICP配位结构的形成。

图3. Dp825:ARS@PDA-Fe(III)-FA ICP NCPs(缩写为NCPs)的制备与表征。(A)Dp825 NPs和(B)NCPs的透射电镜图像;(C)NCPs元素分布图;(D)粒径分布;(E)90天粒径变化;(F)Zeta电位;(G)紫外-可见吸收光谱;(H)红外光谱;(I)X射线衍射谱;(J)X射线光电子能谱全谱;(K)氧元素和(L)铁元素高分辨能谱。
体外实验结果如图4所示,优化的NCPs联合PMN治疗的肿瘤细胞半数抑制浓度为10.90 μg/mL,优化的单次光热治疗时间为10分钟。三轮交替光热-热动力治疗结合双药化疗策略可将细胞活性降至4.35%,任何组分或治疗环节缺失均会削弱疗效。Calcein/PI荧光染色实验结果也证实,该治疗策略可在体外实现几乎完全的肿瘤细胞清除,特别是在高功率激光下仅一轮治疗即无残余活肿瘤细胞,定量结果也表明细胞死亡具有明显的累积效应。该复合治疗体系具有极强的协同效应(联合指数CI=0.072),远优于单一治疗手段,为体内肿瘤根治与预防复发提供了坚实基础。
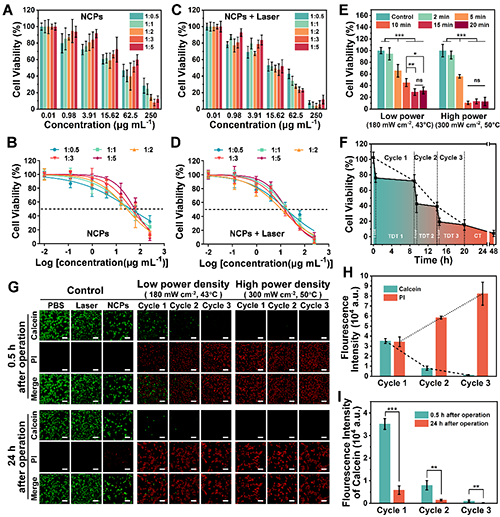
图4. Dp825:ARS@PDA-Fe(III)-FA ICP NCPs(缩写为NCPs)体外疗效实验。(A)不同核壳比NCPs处理的肿瘤细胞生存率和(B)浓度拟合曲线;(C)不同核壳比NCPs联合PMN处理的肿瘤细胞生存率和(D)浓度拟合曲线;(E)光热治疗时间优化;(F)肿瘤细胞生存率变化曲线;(G)Calcein/PI图像;(H)双荧光定量统计;(I)活细胞荧光定量统计。
体内实验结果如图5所示,荷瘤小鼠为模型的结果显示,单药(DOX、ARS)或单一处理(光照、混合药物)均难以显著抑制肿瘤,肿瘤体积增长超初始体积的八倍,而NCPs或PMN单独使用则将增长控制在初始体积的四倍以内。协同策略效果显著提升,尤其是NCPs + PMN组在21天内可实现对大肿瘤(~300 mm3)的100%治愈。肿瘤重量及抑瘤率(TIR)统计进一步验证了该趋势:单药组TIR仅2.5%–34.8%,光学透镜组为29.6%,NCPs组和PMN处理组TIR达68.4%和70.3%,NCPs + PMN组为100%,不但展示出复合纳米粒和PMN系统单独应用的治疗优势,更突出展示了我们提出协同治疗策略的优越性。60天持续观察中,MIX + PMN和NCPs + OL组分别有62.5%与50%的复发率,而NCPs + PMN组无复发。组织学分析显示该组肿瘤细胞结构严重破坏,未见主要器官损伤。该策略仅使用5.0 mg/kg药物剂量,为常规单药剂量的1/10~1/20,远低于最大耐受剂量(550 mg/kg),21天治疗期内各组体重无明显下降,充分发挥了光热治疗、热动力学治疗及化疗的协同治疗优势。具高效低毒的优势,可实现低剂量、高效能的个性化抗肿瘤治疗,为临床转化提供了有力支撑。
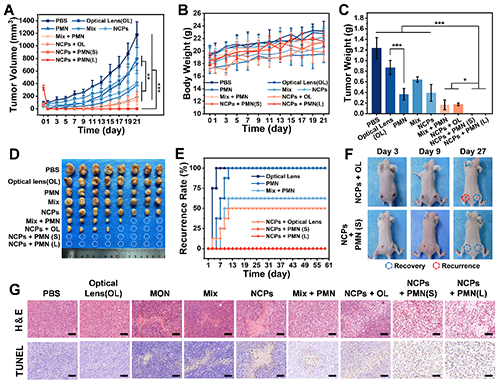
图5. 体内抗肿瘤疗效实验。(A)肿瘤体积增长曲线;(B)小鼠体重变化;(C)肿瘤质量统计;(D)离体肿瘤的照片;(E)60天肿瘤复发统计;(F)光学透镜组与PMN组肿瘤治疗效果对比;(G)肿瘤组织切片染色图像。
相关工作以“Molecular stacking@infinite coordination polymer nanocomposites for tumor continuous high-intensity photothermal-thermodynamic alternate cycle therapy and chemotherapy”为题在期刊ACS Nano上在线发表。吴道澄教授为文章唯一通讯作者,博士生赵晨宇为文章第一作者,西安交通大学生物医学信息工程教育部重点实验室和生命学院为该论文的第一和通讯作者单位。该研究成果是吴道澄教授课题组在肿瘤协同治疗领域的又一重要进展。该工作得到了国家自然科学基金(81871476和32171388),国家博士后创新人才支持计划(BX20220247),陕西省重点研发计划(2022ZDLSF05-17)以及陕西省自然科学基础研究计划(2022JQ-879)等项目的资助。
全文链接:https://doi.org/10.1021/acsnano.5c07772
- 上海交大庄小东教授团队 Adv. Mater.:基于铑-碳配位键的晶态二维配位聚合物 2025-03-28
- 青岛大学夏延致/张克伟教授 Mat. Sci. Eng. R:海藻纤维锚定导电配位聚合物实现超稳定的光热协同传感 2024-09-07
- 苏州大学郎建平教授团队 JACS:配位聚合物单晶平台中光控高分子聚合反应、测定高聚物的单晶结构、奇妙的光致机械运动 2024-09-04
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 常州大学王建浩教授团队《Acta Biomater.》:药物储库型聚合物纳米胶束用于肿瘤长效治疗的研究成果 2025-07-08
- 北京化工大学岳冬梅教授团队 AFM:兼具卓越室温自修复、可回收与极端温度力学稳定性的高强度聚脲弹性体 2025-12-11
