基于多肽抗原的个性化肿瘤疫苗是一种极有前景的肿瘤免疫疗法,然而现有多肽抗原的体内免疫效力仍然较弱,一方面是因为游离抗原肽在体内易酶解,无法有效回流至淋巴结被树突状细胞摄取和递呈;另一方面由于鉴定得到的多肽抗原理化性质各异,难以用统一的载体材料来实施负载。因此,开发可负载多种特异性抗原肽的普适性载体材料仍然十分需要。
中国科学院长春应用化学研究所陈学思院士和宋万通研究员团队近年来致力于高分子肿瘤疫苗载体的研究,先后开发了以甘露聚糖为外壳、聚乳酸为内核的核壳结构仿病毒纳米颗粒疫苗载体(Biomaterials, 2022, 284:121489; Nano Research, 2022, 15: 1183–1192; Fundamental Research, 2024, doi.org/10.1016/j.fmre.2023.03.018),以杂环分子修饰聚乙烯亚胺免疫刺激聚合物为基础的“自佐剂”疫苗载体(Advanced Materials, 2022, 34(10): e2109254; CCS Chemistry, 2024, 6:1278–1288; Sci. Bull. 2024, 69(7), 922-932),以动态共价水凝胶为基础的单剂缓释疫苗载体(Advanced Materials, 2021, 33(3): 2004559; Journal of Controlled Release, 2023, 353, 289-302; Adv. Healthc. Mater., 2024, 34, 2400886)等,用于蛋白及多肽抗原的担载与递送。
近期,该团队针对个性化多肽抗原理化性质各异的问题,利用聚噁唑啉方便功能化及良好生物相容性的特点,合成了一种基于聚噁唑啉的普适性多肽疫苗载体。该载体由多嵌段聚噁唑啉键合TLR7/8激动剂IMDQ构成(PMMEBOx-IMDQ),通过预留双键与修饰有组织蛋白酶B敏感链段(CGFLG)的特异性抗原肽的点击化学反应,可以普适性实现对多种抗原肽的键合担载(图1)。该载体的使用能够显著提升抗原肽向淋巴结的富集水平,大幅提高刺激产生的效应CD8+ T细胞水平,能够让多种“无效”的抗原肽变为“有效”的肿瘤抗原而得以应用。
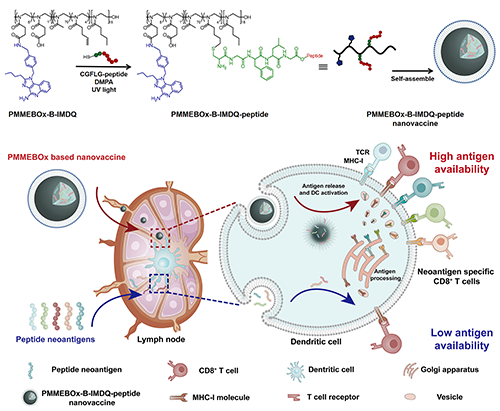
图1 PMMEBOx-IMDQ-peptide的制备流程及体内免疫机制示意图
研究者首先改变羧基噁唑啉单体的投料顺序,制备了两种聚噁唑啉PMMEBOx-R/B-IMDQ疫苗载体,用于调控IMDQ佐剂位于聚合物中的位置。将OVA模型抗原肽(CGFLGSIINFEKL)键合于载体上获得的疫苗纳米颗粒直径为25 nm左右,可显著刺激DC活化(图2)。
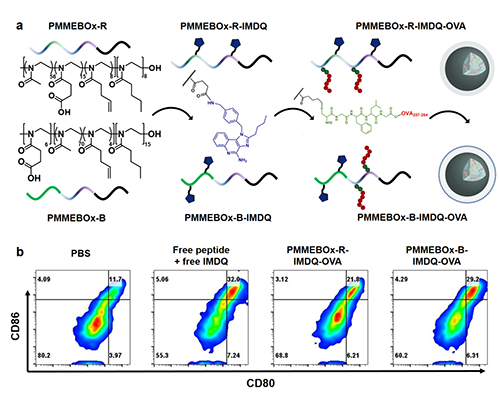
图2 PMMEBOx-R/B-IMDQ-OVA两种载体的制备流程示意图及DC激活表征
PMMEBOx-R/B-IMDQ依靠其纳米颗粒特性,可以显著提升OVA肽的淋巴结富集水平,并使抗原肽驻留在淋巴结内长达6天。此外,其小纳米尺寸还使得抗原肽有效渗透进淋巴结副皮质区,从而提升DC的激活及交叉递呈(图3)。
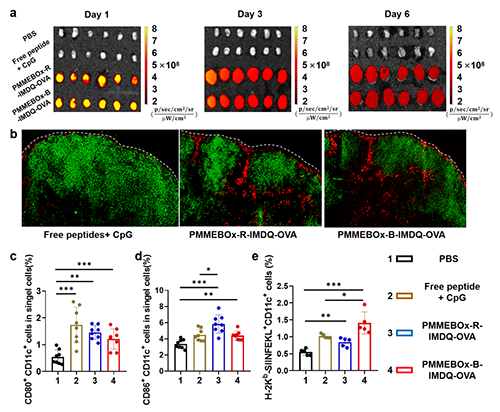
图3 PMMEBOx-R/B-IMDQ-OVA两种疫苗显著提升了OVA肽的淋巴结驻留及渗透
将PMMEBOx-R/B-IMDQ-OVA纳米疫苗用于B16-OVA肿瘤模型的治疗,可有效抑制B16-OVA肿瘤的生长,并在脾脏中产生大量的OVA特异性杀伤T细胞。此外,PMMEBOx-R/B-IMDQ-OVA纳米疫苗相较于游离OVA肽,使小鼠脾脏重量提升了约2.5倍、使小鼠腹股沟淋巴结重量提升了约5.0倍,证明提升了抗原肽系统性免疫响应水平(图4)。
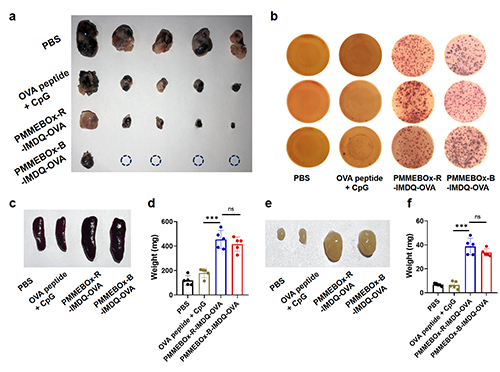
图4 PMMEBOx-R/B-IMDQ-OVA疫苗在B16-OVA肿瘤模型上可有效抑制肿瘤生长并产生OVA特异性杀伤T细胞
随后,该团队从已报道的MC38细胞的突变新抗原中选择了3种疏水抗原肽(Adpgk、Dgapt1、Resp1)进行担载键合,制备了PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1三种纳米颗粒疫苗。这些疏水抗原肽虽然是肿瘤特异性抗原,但由于其理化性质问题无法有效激活体内免疫反应,相反,PMMEBOx-B-IMDQ载体键合的抗原均能产生明显的免疫响应,三种疫苗混合制备的cocktail疫苗取得了出色的肿瘤抑制效果(图5)。
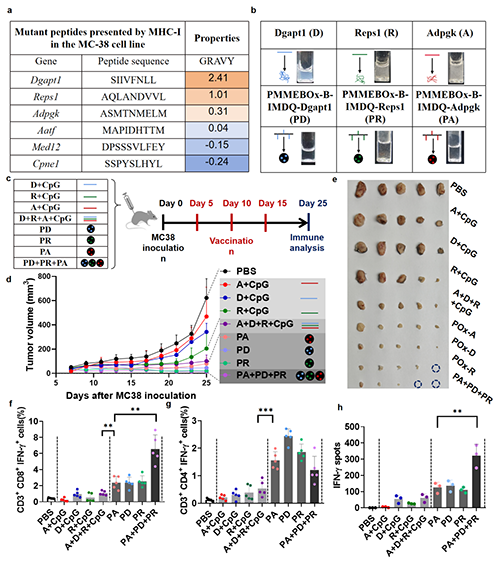
图5 PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1可有效抑制MC38肿瘤生长并产生系统性免疫响应
由于这一键合疫苗形式非常稳定,研究者们最后还探究了静脉注射方式使用该疫苗在体内产生的系统性免疫水平。研究结果证明该疫苗体系可以作为静脉注射方式使用,产生强于皮下的细胞免疫水平(图6)。
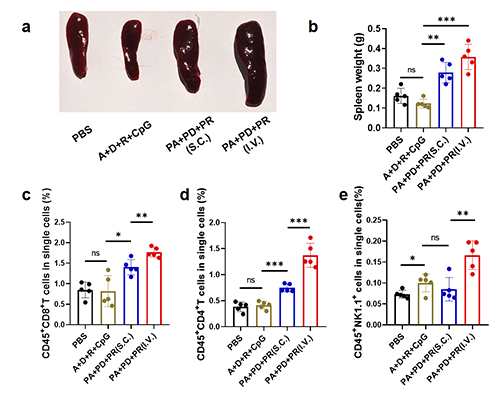
图6 静脉注射PMMEBOx-B-IMDQ-Adpgk/Dgapt/Resp1可进一步提升体内系统性免疫响应
综上,本研究开发了一种能够普适性键合多种特异性抗原肽的疫苗载体PMMEBOx-B-IMDQ。该载体能够显著提升多肽的淋巴结驻留能力并大幅提升抗原肽的系统性免疫响应,极大的提升了特异性抗原的利用率,为特异性多肽疫苗研究提供了新思路。该工作近期以“Uniform polymeric nanovaccine platform for improving the availability and efficacy of neoantigen peptides”为题发表在《Nano Letters》上(Nano Lett., 2024, 24(33):10114-10123. doi: 10.1021/acs.nanolett.4c02196.).长春应化所陈宏宇博士研究生为该论文的第一作者,宋万通研究员和陈学思院士为该论文的通讯作者。该研究得到国家自然科学基金,中国科学院国际合作基金,吉林省科技发展计划等项目的支持。
原文链接:https://doi.org/10.1021/acs.nanolett.4c02196
下载:Uniform polymeric nanovaccine platform for improving the availability and efficacy of neoantigen peptides






