生物膜相关手术部位感染(Biofilm-associated surgical site infection,BSSI)是临床中常见的术后并发症,约占所有手术部位感染病患的80%,极易导致感染患病率的增加、病程迁延、甚至休克死亡。研究人员尝试采用诸多方式(例如抑制细菌初始粘附、干扰菌群信号转导、破坏菌体膜结构等)提高抗生素对BSSI的治疗,但获益十分有限。近年来,载抗生素的微/纳米药物展现出对细菌生物膜的优异治疗效果,其通过生物膜微环境响应性(例如酸性、低氧、酶、细菌抗体等)实现对细菌的靶向治疗。虽然这些微/纳米药物制剂对体表和浅表细菌生物膜(例如皮肤感染、糖尿病溃疡创面、眼部感染、口腔感染、骨科植入物感染等)的治疗已经取得良好的研究进展,但是对深部BSSI的治疗却疗效不佳。BSSI在临床病患中多为体内深部器质性感染,往往病灶较深同时伴随着血管密度分布低、血管结构完整、胞外聚合物基质(EPS)致密等特点,使得微/纳米药物难以有效富集和渗透进入深部BSSI,导致反复感染和预后较差。因此,如何增强抗生素在深部BSSI的富集和渗透提高抗菌疗效是抗菌微/纳米药物研究中需要解决的难题。
近日,浙江大学黄品同教授、周珠贤教授和南京大学顾宁院士团队联合研发了一种胞吞转运级联超声空化的药物递送方式,实现对深部BSSI的高效靶向治疗。该团队首先模拟临床手术过程建立了小鼠深部手术创伤细菌生物膜模型并筛选血管炎性受体,发现血管细胞粘附分子-1 (VCAM1)受体在BSSI病灶血管内皮细胞过度表达,随即提出构建VCAM1受体介导的胞吞转运级联超声激发的空化爆破效应以连续克服BSSI的血管内皮细胞屏障和EPS基质屏障,提高抗生素药物在BSSI的高效富集和深部渗透,实现对细菌生物膜的彻底清除。
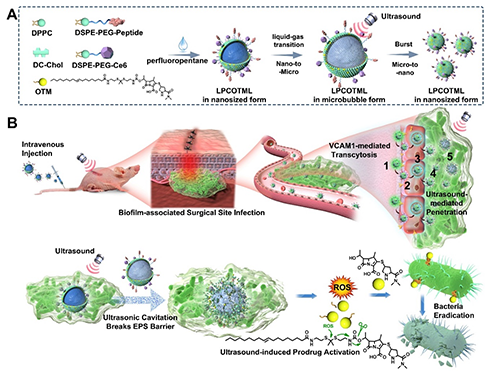
图1. LPCOTML的构建和对BSSI靶向治疗的机制示意图。
实验结果显示:LPCOTML脂质体具有良好的药剂学稳定性、规模化制备重复性和超声刺激响应前药激活及释药特性;LPCOTML通过胞膜窖介导的胞吞和胞吐作用,实现在过表达VCAM1的血管内皮细胞中快速跨细胞转运;LPCOTML在超声辐照下,剧烈爆破EPS基质,使药物能够深部渗透分布整个细菌生物膜组织;LPCOTML在体外和体内均展现出抑制铜绿假单胞菌生物膜的显著疗效,比原药美罗培南和同类对照制剂高出数10倍的抑制效率;在深部BSSI动物模型治疗中,LPCOTML能够高效根除铜绿假单胞菌生物膜,60%以上的小鼠被完全治愈,显著优于临床制剂美罗培南、庆大霉素和Amikacin脂质体的抗菌效果。
参考文献:Guowei Wang, Chengyue Zhang, Zixuan Huang, Jifan Chen, Hongjian Chen, Tao Lin, Zhuxian Zhou, Ning Gu, and Pintong Huang. Transcytosable and Ultrasound-Activated Liposome Enables Deep Penetration of Biofilm for Surgical Site Infection Management, 2024, 2411092.
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202411092
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 四川大学邓怡团队《ACS Nano》:多功能纳米生物异质结复合水凝胶敷料 - 用于伤口细菌生物膜感染的诊疗一体化新策略 2025-03-15
- 港中大张立教授团队《Sci. Adv.》:液态机器人清除复杂表面细菌生物膜 2025-03-15
- 北化徐福建/赵娜娜教授团队 Nat. Commun.:靶向胞外聚合物基质的Janus纳米颗粒用于灵活清除耐药细菌生物膜 2023-08-26
