蛋白质作为生命系统中的关键分子,其折叠过程涉及多种二级结构的形成,包括α螺旋、β折叠和β转角等。这些构象与众多生命活动以及某些疾病的发病机制密切相关。受天然蛋白质结构的启发,近年来科学家们开发了多种策略以调控合成多肽的构象和功能。然而,蛋白质结构的高度复杂性使得对其构象的理解和模拟面临挑战。目前,合成多肽的构象研究主要集中在β折叠、α螺旋和无规线团上,而约占折叠蛋白质和肽残基总数25%的β转角构象却在很大程度上被忽视。β转角在稳定三级结构、启动蛋白质折叠以及介导分子识别中发挥着关键作用,但由于这种构象通常需要强大的侧链-侧链相互作用来稳定,目前在合成聚氨基酸中的研究尚未见报道。另一方面,由于缺乏有效的可视化方法,人们对构象转变及其对大分子多级自组装行为和功能的影响的理解仍十分有限。尽管已有研究尝试通过荧光技术来可视化蛋白质在功能活动中的构象转变过程,但这些方法通常需要对特定氨基酸进行精确修饰或将复杂的荧光共振能量转移(FRET)探针对嵌入蛋白质中,难以直接拓展到合成聚合物的研究中。迄今为止,设计能够可视化构象和功能变化的合成高分子仍然是一个亟待解决的重大挑战。
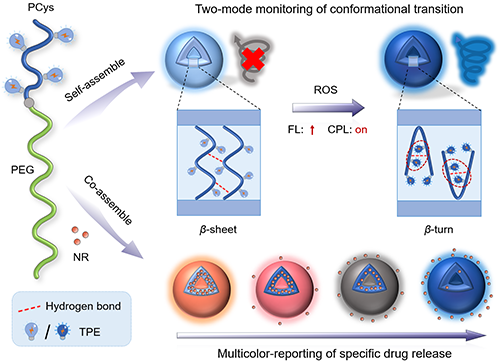
图1 具有可视化构象转变和颜色报告型药物递送功能的发光聚合物囊泡示意图
近日,四川大学高分子科学与工程学院丁明明教授团队开发了一种基于四苯乙烯(TPE)修饰的聚L-半胱氨酸体系,该体系具有多模态光可追踪的二级结构以及颜色报告型药物递送行为。这一研究首次在合成高分子中报道了从β折叠到β转角的构象转变。在该体系中,聚合物中硫醚键的氧化增强了极性并触发构象转变。氧化后,TPE分子之间的CH···π相互作用不仅稳定了β转角构象,还因分子堆积方式的改变而产生手性,增强了荧光发射,进而诱导了圆偏振发光(CPL)。这些现象使得该体系能够通过荧光和CPL的变化实时监测聚合物链的构象转变过程。此外,这种发光聚合物组装体表现出活性氧(ROS)响应的药物释放行为,并可通过多色变化对释药过程进行实时报告(图1)。
首先,研究团队通过N-羧酸酐(NCA)的成环及开环聚合反应,成功合成了嵌段共聚物PEG-PCys-TPE(以下简称PPT)。这种共聚物具有两亲性,能够在水环境中自组装形成聚合物囊泡(图2)。研究结果显示,PPT囊泡在氧化后(PPT-O)荧光显著增强(图2),这一现象表明TPE侧链的堆叠排列可能发生了变化。然而,通过对罗丹明6G包载实验、动态光散射(DLS)、静态光散射(SLS)、透射电镜(TEM)和激光共聚焦显微镜(CLSM)等实验手段的综合分析(图2),研究团队发现形貌变化并非导致荧光增强的原因。
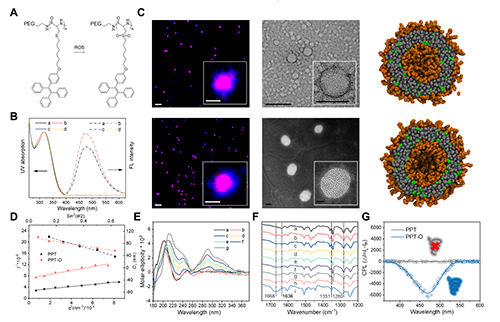
图2 (A)PPT和PPT-O的结构式。(B)PPT(a, c)和PPT-O(b, d)在氯仿中(c, d)和组装体(a, b)状态下的荧光发射光谱(激发波长λex = 318 nm)。(C)PPT(上)和PPT-O(下)组装体的CLSM图像(左)、TEM图像(中)和DPD模拟中的典型横截面视图(右)。(D)PPT和PPT-O自组装溶液的光散射数据:(实线)多角度SLS的典型Berry图;(虚线)不同入射角下的流体动力学直径相关函数。(E)PPT组装体在不同氧化时间下的CD谱图。(F)PPT组装体在不同氧化时间下的FTIR谱图。(G)PPT和PPT-O组装体的CPL谱图。
圆二色光谱(CD)和傅里叶变换红外光谱(FTIR)分析结果证实了聚合物从β折叠构象转变为β转角构象。这种构象转变归因于硫醚基团的氧化,该过程破坏了侧链的疏水堆积(图2)。此外,氧化后的聚合物侧链之间出现了显著的CH···π相互作用。这种相互作用不仅稳定了β转角构象,还诱导了手性以及圆偏振发光的产生(图2)。分子模拟的结果进一步证实了这种氧化诱导的构象转变及其伴随一系列发光现象变化的分子机制(图3)。
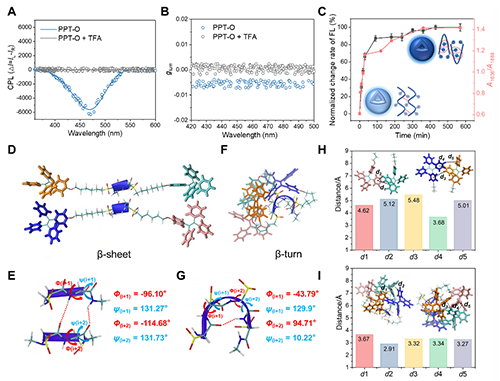
图3 (A, B) PPT-O组装体在三氟乙酸(TFA)处理前后的CPL谱图(A)和发光不对称因子(glum)曲线(B)。(C)PPT在不同氧化时间下的荧光变化率的归一化值以及1636 cm-1与1668 cm-1红外吸收峰强度比值(A1636/A1668)。(D-I)通过DFT计算得到的PPT和PPT-O的二级结构(D, F)、主链的二面角(E, G)以及在相对较近距离处测量的C-H···π相互作用(H, I)。红色虚线表示氢键。

图4 (A)365 nm紫外光(上图)和白光(下图)照射下,用10% H2O2和5%乙酸处理的NR@PPT的药物释放过程图像。(B)NR释放过程中NR@PPT体系的荧光发射颜色的国际照明委员会(CIE)坐标图及其线性拟合。(C, D)氧化(C)和未氧化(D)NR@PPT的荧光光谱。(E)氧化和未氧化NR@PPT的FRET效率变化率。(F)颜色报告型药物释放过程示意图。
为了探究氧化介导的构象转变是否能够触发药物释放,作者将尼罗红(NR)作为疏水性药物模型负载于聚合物囊泡中。实验结果显示,载药体系在氧化条件下表现出高效的响应性释放行为。在释药过程中,体系呈现出从红色到蓝色的显著荧光变化,且荧光色坐标轴x与释药率之间存在很强的线性关系,具体表现为RR(%)= -321.41x + 156.46(R2 = 0.99)。这一结果表明,该载体可以作为一种药物释放比色卡,实时反映体系的药物释放状态(图4)。
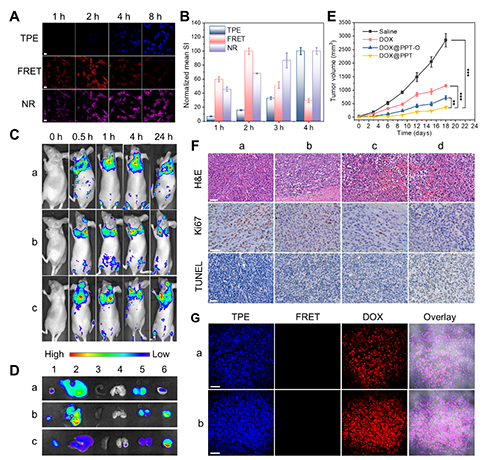
图5(A)氧化条件下与NR@PPT培养不同时间的MCF-7细胞的CLSM图像。(B)不同通道细胞内荧光强度的半定量分析。(C, D)给药后不同时间点的荷瘤小鼠(C)和24小时后的离体组织(D)成像结果。a、b、c分别表示游离DOX、DOX@PPT-O和DOX@PPT。(E)不同处理组小鼠的肿瘤体积变化。(F)肿瘤组织的代表性H&E染色、Ki67和TUNEL免疫荧光染色结果。a、b、c、d分别表示生理盐水、游离DOX、DOX@PPT-O和DOX@PPT。(G)治疗18天后的小鼠体内收集的肿瘤组织的CLSM图像。a、b分别表示DOX@PPT-O和DOX@PPT。
为了探究PPT作为药物递送载体的潜力,作者在模拟肿瘤微环境的条件下对其响应性行为进行了评估。研究发现,自组装体在该条件下仍然能够发生从β折叠到β转角的构象转变,并伴随着持续的药物释放行为。基于此,作者进一步研究了载药体系的生物学性能,发现载药体系在氧化条件下展现出高效的胞内药物递送能力和显著的体内外抗肿瘤效果。此外,未载药的载体本身具有良好的生物相容性(图5)。该研究不仅为深入理解蛋白质的多级结构及其功能提供了新的见解,还为高分子构象的调控开辟了新的方法。此外,该研究为设计智能仿生材料提供了创新的策略和思路。
该工作以“Visual β-Sheet-to-β-Turn Transition in Luminescent Polymeric Vesicles for Color-Reporting Drug Delivery”为题发表于Angew. Chem. Int. Ed. (Doi: 10.1002/anie.202503875)。四川大学高分子科学与工程学院博士研究生李子芬和副研究员刘洋为论文第一作者,丁明明教授为论文通讯作者。该研究工作得到了国家自然科学基金委、四川省科技厅和高分子材料工程国家重点实验室项目资助。
论文链接:https://doi.org/10.1002/anie.202503875
- 中南民大张道洪教授/姜宇教授团队 Macromolecules:高性能超支化聚氨酯微相分离的原位可视化 2026-02-09
- 浙江大学肖锐课题组 Nat. Commun. : 基于单一力敏基团的弹性体应力与损伤可视化 2025-11-26
- 港中深唐本忠/深大熊玉/广工陈树生 AM:通过微胶囊破裂触发原位聚合实现超长室温磷光 - 用于高对比度损伤可视化和高级防伪 2025-11-24
- 东华大学武培怡/焦玉聪团队 Adv. Mater.:溶菌酶构象转变调控锌金属界面电化学 2024-05-09
- 东华大学朱美芳院士/潘绍武研究员 Adv. Funct. Mater.:原位成型生物电极实现高度共形、稳定的电生理信号界面 2024-04-30
- 吉林大学张文科教授团队 Macromolecules:单分子研究揭示聚冠醚链构象转变及其纳米力学性质的离子依赖性 2024-04-09
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
