近日,苏州大学李永强副教授与常州大学王建浩副教授、蒋鹏举教授的纳米生物医学团队合作在Small上发表题为“A nanoFlare-based strategy for in situ tumor margin demarcation and neoadjuvant gene/photothermal therapy”的封底论文(Small, 2018, 14, 1802745;Back Cover),严荣、陈杰、王建浩副教授为该论文的共同第一作者,李永强副教授为通讯作者。《Small》由Wiley-VCH集团出版,位列顶级多学科期刊行列 (中科院一区TOP期刊,影响因子为9.598),所发表的有关纳米和微尺度的研究涵盖了材料科学、化学、物理学、工程学、医学和生物学等多个领域。
恶性肿瘤是人类死亡原因中的第二大原因,目前手术切除是主要治疗方式。然而由于肿瘤组织的浸润性和不规则性,对肿瘤组织的准确识别和划分一直是目前临床肿瘤手术中的难点,从而往往导致术后肿瘤的高复发和高转移。因此,对恶性肿瘤的边界精准区分是保证肿瘤治疗效率的重要前提条件。
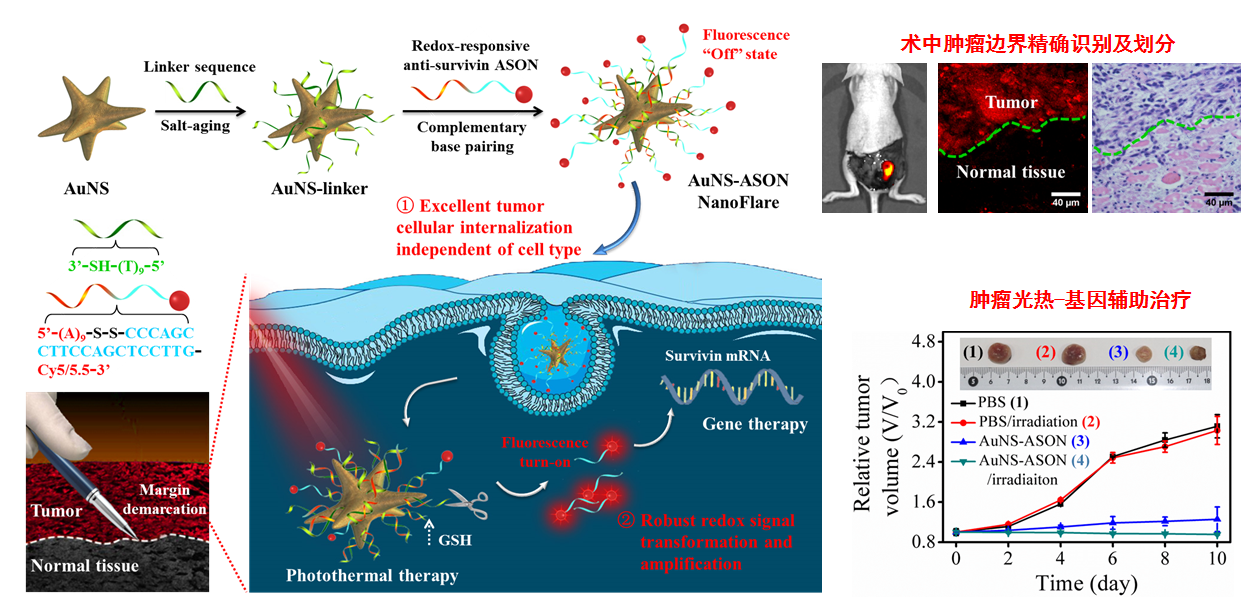
纳米耀斑(Nanoflares)是一种具有金纳米颗粒核心和单链荧光标记DNA层修饰的纳米探针,其表面三维的DNA修饰层使其具有极强的细胞膜穿透和干扰胞内核酸分子转录和翻译的特性,在肿瘤细胞的识别和杀灭方面得到了广泛关注。基于NanoFlare的概念,并利用癌细胞内存在的高浓度谷胱甘肽,本工作合成了金纳米星颗粒,并在其表面高效负载插入有二硫键的survivin反义寡核苷酸分子(Cy5.5标记),构建了具有谷胱甘肽特异性响应的NanoFlare探针(AuNS-ASON)。该探针本身由于发生荧光共振能量转移处于荧光淬灭状态,但是它可以快速穿过细胞膜,从溶酶体中逃逸出来,并在遇到肿瘤细胞中高浓度谷胱甘肽的激活后发生荧光恢复,成功实现了对小鼠模型术中不同类型肿瘤边界的准确区分。此外,基于金纳米星优异的光热特性以及survivin反义寡核苷酸分子对肿瘤高效的基因治疗作用,NanoFlares探针在对肿瘤边界进行准确区分的同时,还实现了对其的高效光热-基因协同治疗。

该工作充分利用了NanoFlares在荧光激活成像和基因治疗方面的潜力,同时利用肿瘤组织内含有的高浓度谷胱甘肽,有望为肿瘤的精确诊断和高效治疗提供一种新思路和新手段。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/smll.201870245
- 福建师大杨震/张先增、西工大黄维 Adv. Sci.:极化调控与界面缺陷工程协同增强光-热释电效应 - 助力肿瘤治疗 2026-03-01
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 东华大学史向阳教授/沈明武研究员团队 AFM: 双驱动纳米马达用于高效肿瘤光热治疗及治疗后炎症缓解 2025-03-17
- 香港科大唐本忠院士团队/武大王富安课题组 JACS:设计一种AIE螺环近红外发射探针用于DNAzyme敏化增强的乳腺癌光热治疗 2024-12-14
- 北航潘曹峰教授/河南大学曹瑞瑞副教授团队 AFM:用于运动能量收集和光热治疗的摩擦电功能纺织品 2024-12-07
