最近的研究中,可将外部能量或化学信号转化为机械动能的自推进纳米马达因其在生物医学应用中的巨大潜力而受到越来越多的关注。与传统无运动特征的纳米载体系统相比,纳米马达的运动能力使其可以主动穿透细胞膜进入细胞,并实现增强的肿瘤渗透。纳米马达可将激光的光能转化为热能,从而通过热泳动驱动用于细胞内药物递送及组织穿透。考虑到金(Au)的光热特性,不同形态的Au已通过共价结合或喷射涂层技术与纳米载体结合以构建热泳纳米马达。然而,在这些纳米马达中Au的尺寸大多数都大于10 nm,这不利于最大化Au的光热转化效率及纳米医学应用,并且尺寸较小的Au更易实现在纳米马达上的可控分布。最近,荷兰埃因霍温理工大学Jan van Hest教授课题组将聚乙二醇-b-聚(D,L-丙交酯)(PEG-PDLLA)共聚物自组装,通过透析诱发形变制备了碗状聚合物囊泡(bowl-shape Polymersomes),因其形貌类似口形红细胞又可称为Stomatocytes。各向异性的Stomatocytes自带的不对称流线型结构使其可在外部刺激的推动下进行定向运动,因而被作为纳米马达的基底平台,进行了广泛研究。其中,涂覆了Au的Stomatocytes(Au-Stomatocytes)可以利用Au的光热特性,在激光照射下进行定向的热泳动,并具有触发光热治疗(photothermal therapy, PTT)的潜力。此外,Stomatocytes的内部空腔还可进一步用于负载药物或功能化纳米颗粒,从而扩展Stomatocytes的治疗活性。
考虑到肿瘤的高效治疗如化疗、放疗及PTT等总是伴随着肿瘤细胞免疫原性死亡的发生,这将导致损伤相关分子模式(DAMPs)的释放和抗肿瘤免疫的激活。然而,在PTT过程中对肿瘤部位进行局部激光照射引起的高温会使大多数肿瘤细胞坏死,从而释放过量的DAMPs、诱发炎症反应、引发细胞因子风暴,使光照区域皮肤严重损伤并使肿瘤易复发转移。因此,有必要设计一种智能纳米药物,可在PTT后缓解过度活化的免疫反应,从而在抗肿瘤免疫激活和炎症反应可控性之间取得平衡。
为了最大限度地发挥Au-Stomatocytes在PTT中的优势,东华大学史向阳教授/沈明武研究员团队将具有多种类酶活性和抗炎能力的氧化铈纳米颗粒(CeO2-x NPs)整合进Stomatocyte体系中,通过简单的方法制备了一种表面修饰金纳米颗粒(Au NPs)、内部负载CeO2-x NPs、外围进一步仿生伪装癌细胞膜(cancer cell membranes,CM)的纳米药物,可作为双驱动纳米马达用于运动增强的肿瘤PTT(图1)。负载的CeO2-x NPs不仅可以作为炎症清除剂调控PTT后的炎性肿瘤微环境(tumor microenvironment, TME),还可以利用类酶活性在缺氧的TME中产生O2,进一步增强PTT的效果。
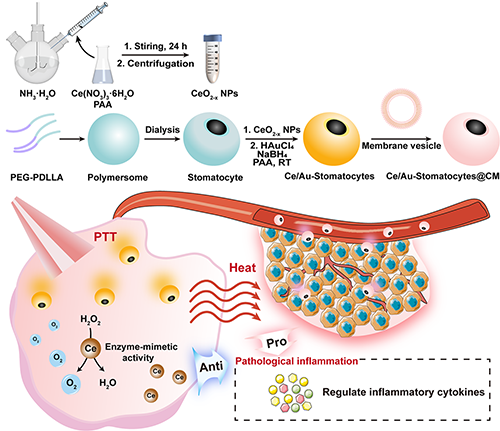
图1. Ce/Au-Stomatocytes@CM的合成及其用于体内抗肿瘤光热治疗示意图。
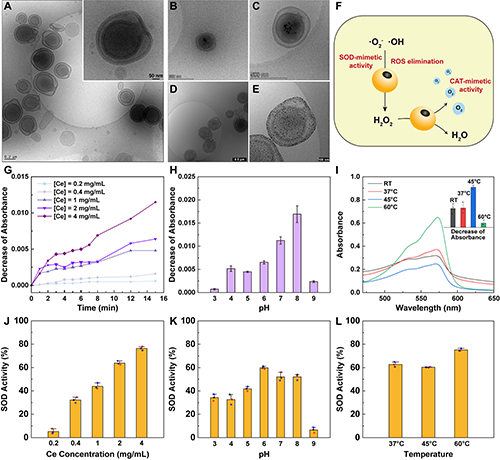
图2.(A-E)不同阶段Stomatocytes的cryo-TEM图;(F)Ce/Au-Stomatocytes的类酶活性作用机制;(G-I)不同条件下Ce/Au-Stomatocytes的类CAT酶活性;(J-L)不同条件下Ce/Au-Stomatocytes的类SOD酶活性。
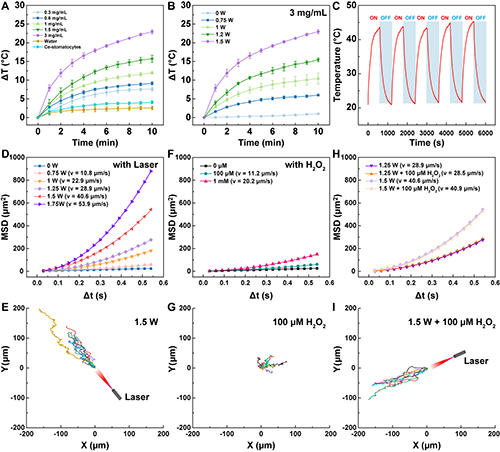
图3.(A-C)Ce/Au-Stomatocytes的光热性能;(D-I)Ce/Au-Stomatocytes在不同条件下的运动性能。
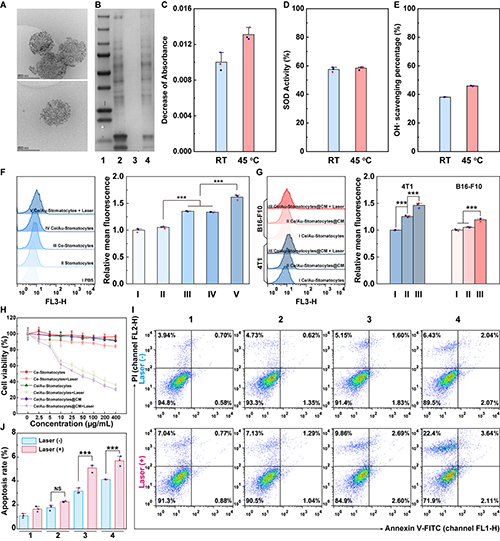
图4.Ce/Au-Stomatocytes@CM的(A)cyro-TEM图及(B)SDS-PAGE图;(C-E)Ce/Au-Stomatocytes@CM在不同条件下的类酶活性;(F)不同Stomatocytes在4T1细胞中的吞噬情况;(G)Ce/Au-Stomatocytes@CM在不同细胞中的吞噬情况;经不同处理后4T1细胞的(H)细胞活力图及(I-J)凋亡情况流式分析图。
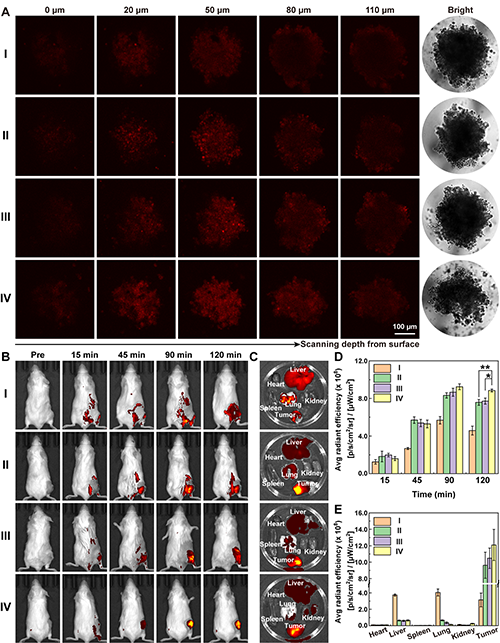
图5.不同情况下Stomatocytes在(A)3D肿瘤细胞球中的渗透情况及(B-E)小鼠体内的生物分布(I: Au-Stomatocytes, II: Au-Stomatocytes@CM, III: Ce/Au-Stomatocytes@CM, and IV: Ce/Au-Stomatocytes@CM + Laser)。
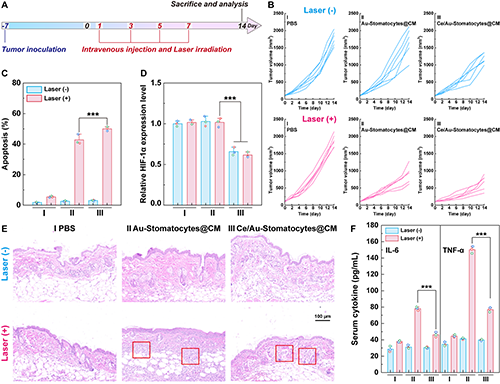
图6.(A)体内抗肿瘤治疗时间线;(B)治疗期间各组小鼠肿瘤体积变化;治疗后各组小鼠(C)肿瘤细胞凋亡率及(D)HIF-1α表达水平;治疗后各组(E)肿瘤外侧皮肤的H&E 染色分析及(F)血清中细胞因子的表达情况。
总的来说,该研究设计的基于Stomatocytes的纳米马达具有多个优势:1)表面沉积的Au NPs赋予了Stomatocytes光热性能及运动特性,使其可以在激光照射下进行自主运动穿透肿瘤进行PTT;2)CeO2-x NPs的类酶活性使Stomatocytes不仅可以在TME中产生O2用于驱动运动、缓解肿瘤乏氧,还可以清除ROS以调控PTT后的炎症水平;3)经CM仿生后的Ce/Au-Stomatocytes@CM可通过同源靶向聚集在肿瘤部位,在激光照射下穿透肿瘤进行PTT,同时调节炎症反应缓解激光照射对表层皮肤的损伤。
文章链接:https://doi.org/10.1002/adfm.202500113
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 香港科大唐本忠院士团队/武大王富安课题组 JACS:设计一种AIE螺环近红外发射探针用于DNAzyme敏化增强的乳腺癌光热治疗 2024-12-14
- 北航潘曹峰教授/河南大学曹瑞瑞副教授团队 AFM:用于运动能量收集和光热治疗的摩擦电功能纺织品 2024-12-07
- 武汉科技大学王晓强《Nano Lett.》:基于硼簇的“离液效应”构建细菌响应型水凝胶用于近红外二区光热治疗 2024-04-09
