结直肠癌(CRC)是全球第三大最常见的恶性肿瘤,每年新发病例超过190万例,死亡人数接近93.5万。尽管近年来免疫疗法已在多种癌症治疗中取得了显著突破,但结直肠癌患者的免疫治疗反应仍然较差,尤其是在错配修复缺陷(dMMR)或微卫星不稳定(MSI-H)的患者中,免疫检查点抑制剂的效果并不理想。CRC的免疫逃逸机制复杂,肿瘤微环境中存在大量免疫抑制性因素,尤其是肿瘤相关巨噬细胞的作用,这些免疫细胞在CRC的发生和发展中扮演着双重角色。一方面,巨噬细胞作为先天免疫系统的重要组成部分,能够识别和清除肿瘤细胞;另一方面,当巨噬细胞受到细菌等微生物的影响,尤其是细胞内细菌的感染时,它们往往会转变为M2型极化,促进免疫抑制环境的形成,进一步助长肿瘤的生长和转移。
在CRC研究中,越来越多的证据表明,肿瘤微环境中的细菌,尤其是细胞内细菌,扮演着免疫逃逸的关键角色。例如,具核梭杆菌(Fusobacterium nucleatum,Fn)作为一种特异性定植在CRC肿瘤中的细菌,能够通过感染肿瘤相关巨噬细胞,改变它们的免疫表型,诱导免疫抑制环境的形成。这种细菌通过激活TLR4/NF-kB/S100A9信号通路,调节CXCL2/CXCR2轴,促进M2型巨噬细胞极化,同时还能招募骨髓来源抑制性细胞,进一步加剧免疫逃逸。更为复杂的是,Fn的细胞内存在能够增强肿瘤免疫逃逸的机制,这也是许多CRC患者对免疫检查点抑制剂反应不佳的重要原因。
然而,尽管抗生素在治疗细菌感染方面被广泛应用,但其对细胞内病原体,特别是肿瘤微环境中的细菌,效果有限。传统的抗生素因细胞内滞留、快速耐药性产生以及对肠道菌群的破坏,往往无法有效控制肿瘤中的细菌感染。此外,抗生素的非特异性释放也可能对正常细胞产生不良影响。因此,开发能够精确靶向肿瘤细胞内细菌的创新治疗方法成为了一个紧迫的挑战。
为解决这一挑战,天津工业大学高辉教授与余云健博士团队开展了一系列研究,旨在通过纳米技术精准干预肿瘤微环境,提升免疫治疗的效果。近期,团队发表了一项研究,提出了一种自激活聚合物纳米酶(AS@PMFM),该纳米酶能够精准靶向并清除肿瘤相关巨噬细胞内的Fn。
2026年2月19日,相关研究成果以“Engineered Self-Activatable Polymeric Nanozymes Precisely Eradicate Tumor-Associated Intramacrophage Bacteria to Potentiate Immunotherapy Based on Cluster of Differentiation 47 Blockade”为题发表在ACS Nano上(DOI: 10.1021/acsnano.5c15423)。天津工业大学余云健博士为第一作者,通讯作者为高辉教授。感谢硕士生白佳璐对本工作所做的突出贡献,同时感谢国家重点研发计划、国家自然科学基金以及天津市重点基金对本工作的资助!
与传统的抗生素不同,这种纳米酶采用了高度针对性的靶向策略,能够通过甘露糖受体介导的内吞作用,选择性地进入感染的M2型巨噬细胞。一旦进入细胞,过量的氢过氧化物激活纳米酶,释放出二价铁(Fe2+)和青蒿素(AS),利用Fenton反应产生大量的氧化应激,从而有效杀灭Fn。同时,青蒿素通过诱导巨噬细胞自噬,将纳米酶和细菌共定位于自噬溶酶体,确保细菌的精准清除。这一研究的关键创新在于,通过消除Fn,逆转了感染巨噬细胞的免疫抑制表型,并通过CXCL2/LPS轴的激活,促进未感染巨噬细胞向M1型极化,全面重塑了肿瘤免疫微环境。与anti-CD47抗体联合使用时,AS@PMFM表现出了强大的协同效应,显著增强了免疫治疗的效果,抑制了肿瘤生长,并延长了小鼠的生存期。
值得一提的是,团队一个月前在《Journal of Controlled Release》期刊上发表的另一篇研究,也展示了他们在细胞内细菌清除和免疫治疗联合增效方面的持续探索。该研究开发了一种名为MTCP-NPs的智能纳米前药,通过双重锁定激活机制,精准靶向M2型巨噬细胞,清除胞内的Fn。该治疗不仅有效消除了细菌,还通过解除T细胞的免疫抑制,增强了抗PD-L1免疫治疗的效果。两项研究共同展示了该团队在细胞内细菌清除与免疫治疗结合方面的创新成果,进一步推动了精准免疫治疗在CRC中的应用。这些研究成果为免疫治疗提供了新的策略,通过精准消除肿瘤微环境中的细菌并重塑免疫系统,增强了免疫治疗的效果,展示了纳米技术在癌症治疗中的巨大潜力。
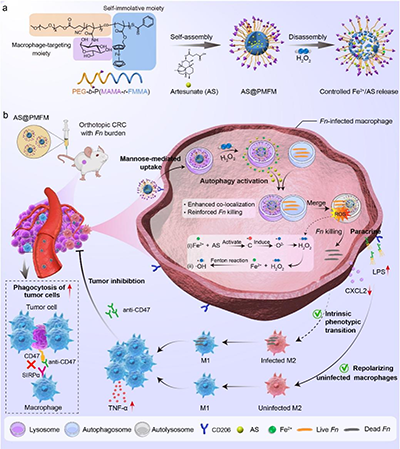
图1. (a) 巨噬细胞靶向自激活聚合物纳米酶(AS@PMFM)的自组装与H2O2诱导解体示意图;(b) AS@PMFM在Fn定植的原位CRC小鼠模型中的治疗机制
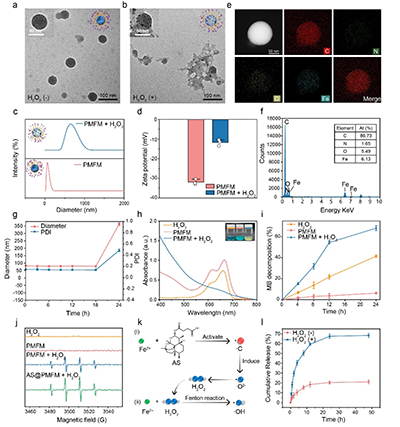
图2. 聚合物纳米酶的制备与表征
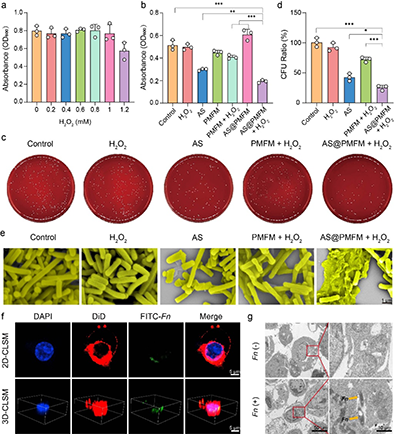
图3. 细胞外抗菌作用及巨噬细胞内Fn测定
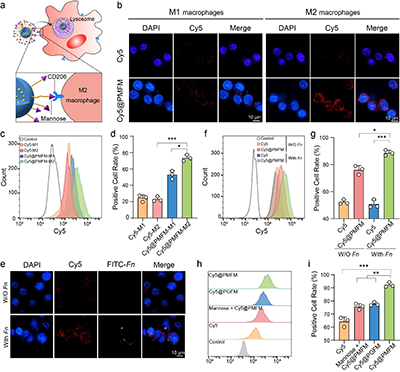
图4. M2巨噬细胞特异性内化
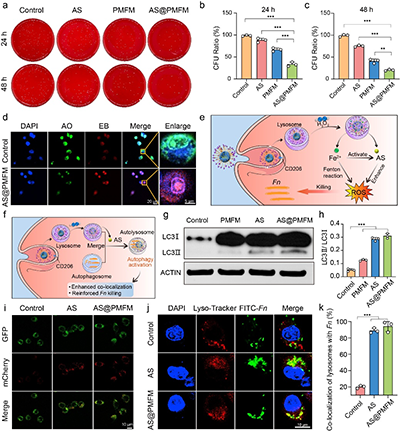
图5. 由自噬激活驱动的细胞内抗菌活性
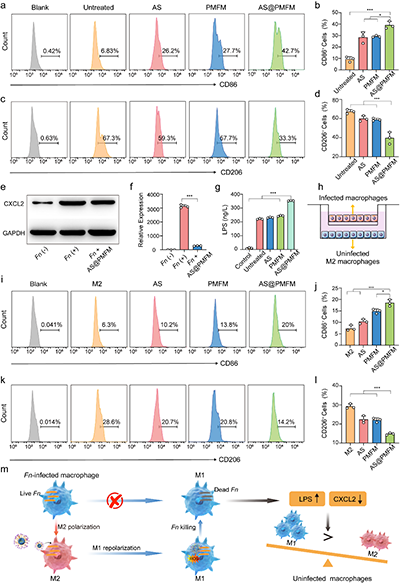
图6. 细胞内Fn杀伤后感染和未感染M2巨噬细胞的M1复极化
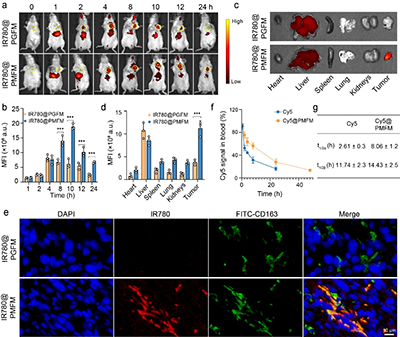
图7. 体内生物分布和药代动力学研究
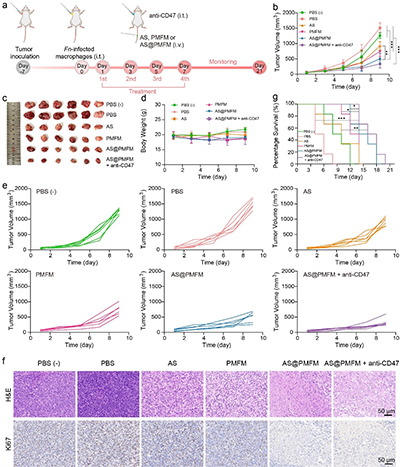
图8. CRC皮下肿瘤模型的体内抗肿瘤效果评估
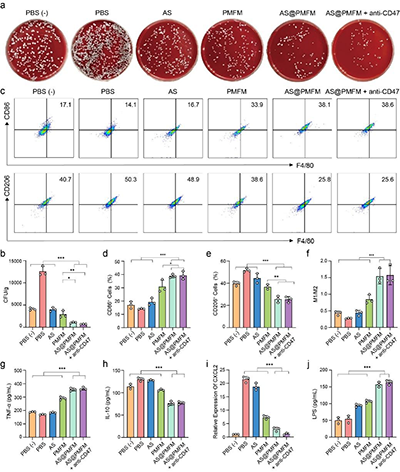
图9. 肿瘤细胞内Fn消除后肿瘤相关巨噬细胞的重编程
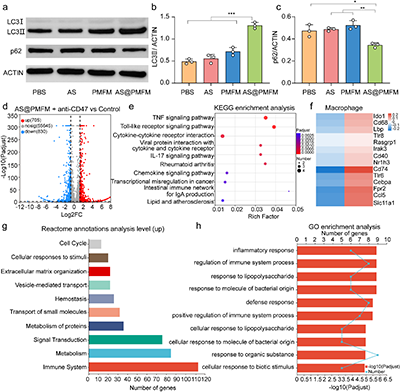
图10. 体内自噬激活及免疫反应刺激机制分析
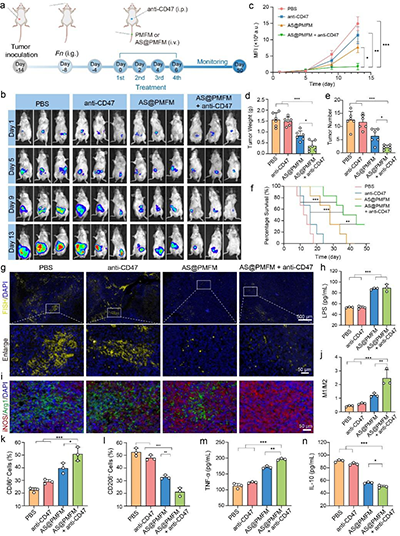
图11. 原位CRC肿瘤模型的体内抗肿瘤效果评估
论文链接:https://doi.org/10.1021/acsnano.5c15423
- 杭师大黄又举教授团队 AFM:超强H2O2亲和力的体外医疗诊断试剂盒 2025-09-08
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 中山大学吴丁财/黄榕康/郑冰娜/王辉团队 Adv. Mater.:具有长驻留性的可注射多孔炭纳米酶水凝胶实现肿瘤的协同治疗 2025-07-04
- 天工大高辉/李晓晖团队 Acta Biomater.:二甲双胍多功能纳米药物克服具核梭杆菌介导的结直肠癌化疗耐药与免疫抑制 2025-02-11
- 天工大高辉/余云健团队 JCR:肿瘤和瘤内病原体级联靶向光热纳米制剂用于增强结直肠癌免疫治疗 2025-01-27
- 天工大高辉教授团队 AHM:提升结直肠癌的抗血管生成基因疗法重塑炎症和免疫抑制性肿瘤微环境 2024-12-26
- 山东大学崔基炜教授团队《Adv. Mater.》:“以瘤治瘤”的水凝胶疫苗 - 实现个性化肿瘤免疫治疗新突破 2025-10-09
