肿瘤疫苗的目标是“唤醒”身体自身的免疫系统,使其主动、精准地识别并清除肿瘤细胞。然而,肿瘤的复杂性与多变性使得通用疫苗难以奏效,而个性化肿瘤疫苗能精准锁定其肿瘤特有的抗原,从而激发有效且持久的免疫力。但如何为肿瘤患者匹配特异性的抗原是制备个性化肿瘤疫苗的难点和挑战。
近日,山东大学崔基炜教授团队开发了一种基于水凝胶的个性化肿瘤疫苗(图1)。这个递送系统的创新之处在于:(1)“以瘤治瘤”的个性化抗原:利用自组装纳米颗粒诱导肿瘤细胞发生“免疫原性死亡”,从而获取来自患者自身肿瘤的抗原,这种方法绕过了复杂耗时的抗原鉴定过程,实现个性化定制。(2)长效缓释的“疫苗储库”:将免疫原性死亡的细胞与STING佐剂(MSA-2)同时分散在海藻酸钠溶液中,将其注射到皮下后能够与体内原有的钙离子迅速形成凝胶,持续释放抗原,单次注射即可激活长效的免疫记忆。(3)“协同激活”实现肿瘤预防与治疗:MSA-2与锰离子协同激活STING通路,诱导特异性免疫反应和强大的免疫记忆,致使“水凝胶疫苗”不仅能有效预防原发性肿瘤,还能抑制肿瘤的转移。这项研究为实现“一次注射,长久起效”的个性化肿瘤免疫治疗提供了新策略。
相关研究成果以“Personalized Vaccination of Tumor‐Derived Antigens and STING Agonists for Specific Cancer Immunotherapy”为题发表在Advanced Materials上。山东大学化学与化工学院崔基炜教授为该论文的通讯作者,山东大学博士后王宁为该论文的第一作者。
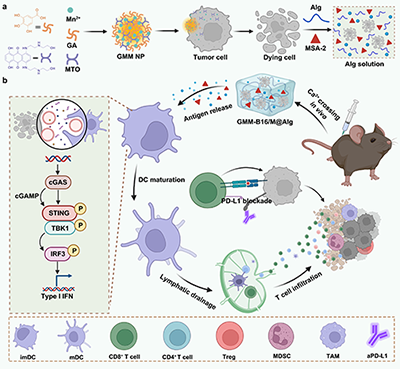
图1. (a) 个性化疫苗前体的制备。由没食子酸(GA)、锰离子(Mn2+)和米托蒽醌(MTO)自组装形成的GMM NPs与黑色素瘤B16细胞共培养诱导细胞的免疫原性死亡,随后与MSA-2激动剂及海藻酸钠溶液混合制得疫苗前体。(b) 将疫苗前体皮下注射至小鼠体内,通过钙离子原位交联形成水凝胶。
研究团队开发的海藻酸钠水凝胶疫苗能在体内钙离子触发下快速成胶,构筑了长效的疫苗储库(图2)。免疫原性细胞死亡通过释放HMGB1和钙网蛋白等危险信号,研究证实GMM NPs能显著增强该效应,并通过激活STING通路使干扰素-β(IFN-β)的分泌提升2.2倍,有效促进树突状细胞活化与T细胞免疫应答(图3)。水凝胶疫苗在体内持续释放抗原,有效招募并激活抗原呈递细胞,促进T细胞增殖与杀伤功能;实验证实了该个性化疫苗仅对同源肿瘤产生显著抑制效果,凸显了自体肿瘤抗原在精准免疫治疗中的关键价值(图4-6)。该技术突破了传统个性化疫苗抗原筛选复杂的瓶颈,为实现高效、通用的个性化肿瘤免疫治疗提供了新思路。
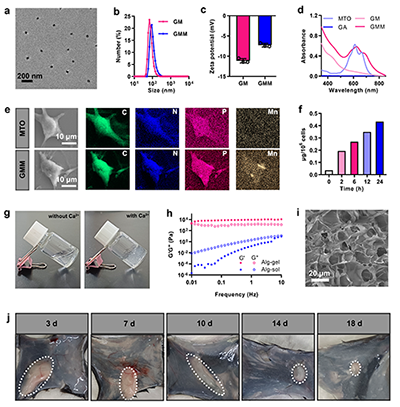
图2. GMM NPs的透射电子显微镜图像(a)和粒径分布(b)。(c) GM和GMM NPs的Zeta电位。(d) MTO、GA、GM NPs和GMM NPs的紫外-可见吸收光谱。(e) 扫描电子显微镜图像及相应的C(绿色)、N(蓝色)、P(紫红色)和Mn(黄色)元素分布图。(f) 不同时间点细胞摄取GMM NPs的ICP-MS分析结果。(g) 加入Ca2?前后海藻酸钠溶液(1%)的宏观形态。(h) 海藻酸钠溶液与水凝胶的流变学表征。(i) 海藻酸钠水凝胶的扫描电子显微镜图像。(j) 不同时间点海藻酸钠水凝胶在体内的宏观形态。
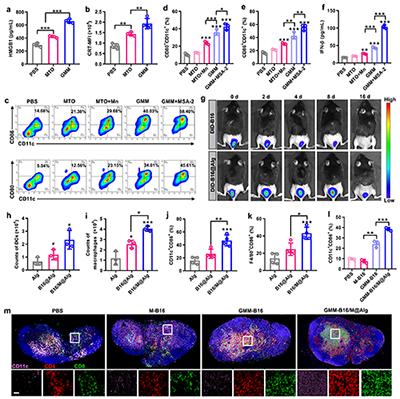
图3. (a) 通过酶联免疫吸附测定(ELISA)检测纳米颗粒刺激细胞后上清液中的HMGB1水平(n=4)。(b) 流式细胞术检测肿瘤细胞表面钙网蛋白的表达情况(n=4)。(c) 代表性流式细胞图及(d)CD86+和(e)CD80+在不同样品处理后的比例(n=3)。(f) ELISA检测细胞上清液中IFN-β水平(n=3)。(g) 小鼠注射部位DID标记肿瘤细胞体内成像分析。注射后第3天凝胶内募集(h)树突状细胞和(i)巨噬细胞的定量分析(n=3)。(j) 募集细胞中CD86+树突状细胞和(k)CD86+巨噬细胞的比例(n=4)。(l) 疫苗接种后淋巴结中CD80+树突状细胞的比例(n=3)。(m) 疫苗接种后淋巴结切片的免疫荧光分析,显示相应细胞的表型。
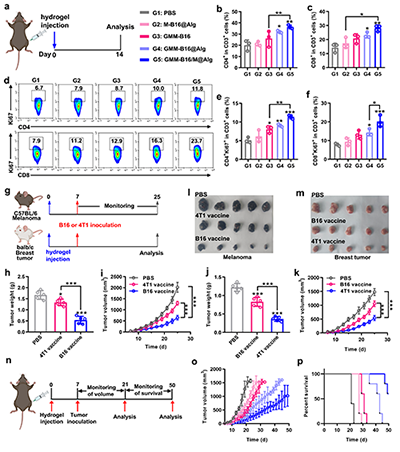
图4. (a) 免疫治疗方案时间安排。流式细胞术定量分析不同组别引流淋巴结中:(b) CD3+ T细胞门控的CD4+T细胞和(c) CD8+ T细胞比例(n=3)。(d) 流式细胞图及不同组别引流淋巴结中CD3+T细胞门控的(e) CD4+Ki67+和(f) CD8+Ki67+ T细胞定量分析(n=3)。(g) 个性化免疫治疗方案时间安排。(h-k) B16和4T1荷瘤小鼠治疗期间的肿瘤重量及肿瘤生长曲线(n=5)。(l) B16和(m) 4T1肿瘤组织标本照片。(n) 肿瘤预防性免疫应答机制示意图。(o) 各组平均肿瘤生长曲线(n=5)。(p) 各组生存率统计(n=5)。
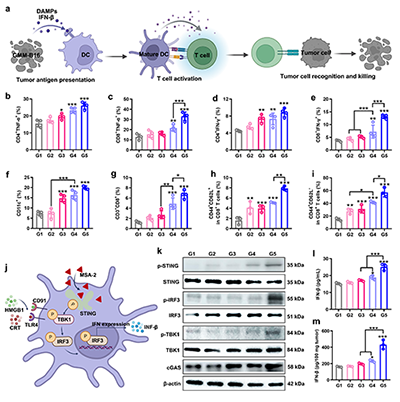
图5. (a) 基于水凝胶疫苗的抗肿瘤免疫应答过程示意图。脾脏CD3+T细胞中(b)TNF-α+CD4+、(c) TNF-α+CD8+、(d)IFN-γ+CD4+和(e) IFN-γ+CD4+ T细胞的定量分析(n=4)。(f) 各组肿瘤组织中树突状细胞与(g) CD8+T细胞的相对定量(n=4)。(h)脾脏中央记忆T细胞(Tcm,CD44+CD62L+)与(i) 效应记忆T细胞(Tem,CD44+CD62L-)的相对定量(n=3)。(j) STING激动剂作用后细胞内通路变化示意图。(k) 不同处理后STING通路相关蛋白的Western blot检测结果。(l) 各组小鼠血清中IFN-β浓度检测(n=3)。(m) 不同治疗后肿瘤组织内IFN-β水平测定(n=3)。
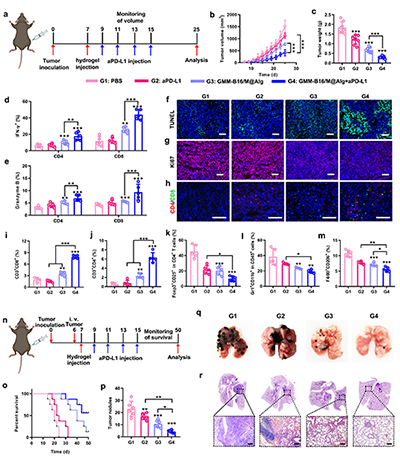
图6. (a) 动物实验设计示意图。(b) 各组平均肿瘤生长曲线(n=5)。(c) 第25天各组肿瘤重量。(d) 脾脏CD8+T细胞与CD4+ T细胞中IFN-γ+的定量分析。(e) 脾脏CD8+ T细胞与CD4+ T细胞中Granzyme B+的定量分析(n=5)。(f) 离体肿瘤切片的TUNEL染色与(g) Ki67染色检测,标尺为200μm。(h) 肿瘤组织中CD4+与CD8+ T细胞浸润的免疫荧光分析,标尺为200μm。(i) 肿瘤内CD3+CD8+ T细胞、(j) CD3+CD4+ T细胞、(k) CD4+细胞中Foxp3+CD25+(Treg)、(l) CD45+细胞中Gr1+CD11b+(MDSCs)、(m) F4/80+CD206+(M2-TAM)的定量分析(n=5)。(n) 肿瘤转移联合治疗方案时间轴。(o) 各组随时间变化的生存率(n=8)。(p) 不同组小鼠转移瘤结节数量统计(n=6)。(q) 肺组织代表性照片。(r) 离体肺组织切片的H&E染色分析。
上述研究工作得到国家自然科学基金、山东省自然科学基金的资助和支持。
原文链接:http://doi.org/10.1002/adma.202420325
- 西南交大杨维清教授/邓维礼副教授 Adv. Mater. 综述:离子水凝胶传感器 - 迈向下一代个性化健康监测 2025-10-31
- 清华大学/北京清华长庚医院李舟、邹洋 AFM:受应力激励的仿生表皮传感吸盘用于个性化心血管监测 2025-09-30
- 湘潭大学王秀锋教授 Lab Chip:基于热反馈实现个性化水合管理的皮肤可贴合微流控技术 2024-11-02
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 东南大学葛丽芹教授团队 Adv. Sci.:开发甘露糖修饰金属-多酚微胶囊 重塑巨噬细胞表型助力肿瘤免疫治疗 2025-03-05
- 重庆大学蔡开勇/冯茜团队 ACS Nano:基于自编织技术制备的GSH响应性和H?S自生成纳米笼用于优化肿瘤免疫治疗 2024-04-04
