骨缺损修复是临床医学中的重大挑战,现有骨移植材料常面临机械性能不足、操作不便、降解不可控及成骨活性有限等问题。尽管羟基磷灰石、生物玻璃等无机材料在骨修复中广泛应用。通常,无机材料首先以粉末形式制备。然后,粉末通过烧结或通过耗时的水合过程,或通过分散在坚韧的有机网络中进行固结。然而,天然骨组织的形成可以在温和的生理条件形成。在骨组织生成过程中,无定形磷灰石颗粒在胶原蛋白和非胶原蛋白聚糖的介导下形成作为前驱体。然后,前驱体通过颗粒-颗粒融合产生骨架,从而实现了从无机颗粒构建整体的骨骼。然而,现有的磷酸钙颗粒难以用于实现仿天然骨骼的形成,其活性是限制整体组装的关键因素之一。
四川大学李旭东教授课题组长期致力于研究多种天然物质对无机晶体的结构特性的影响和机制,以及材料的生物学效应。例如,海藻酸钠的仿生矿化体系调控合成纳米针状磷灰石(Langmuir 2018, 34, 6797-6805. Biomaterials Science 2020, 8, 19, 5390-5401. Cryst. Growth & Des. 2015, 15 ,4, 1949-1956.)、透明质酸基受控矿化体系构建多形貌的磷灰石颗粒(Carbohydrate Polymers. 2023, 322 121345. Chem. Commun. 2010, 46, 1278-1280. Front. Mater. Sci. 2012, 6, 4, 283-296. Adv. Appl. Ceram. 2016, 115, 1-5.)、纤维素控制针状磷灰石构建超薄纳米带(Inorg. Chem. 2018, 57, 4516-4523. 化学研究与应用,2013, 25, 7, 994-998.)、茶多酚对无机磷酸钙和草酸钙结晶的影响(J Biomed Mater Res Part B 2015, 103B, 1525-1531. Cryst Eng Comm 2010, 12, 845-852.)、透明质酸调控形成顶状不对称方解石晶体(Cryst. Growth Des. 2010, 10.)、明胶调控形成单分散CaCO3花瓣球形微粒(化学研究与应用,2010, 22, 5, 574-578.)、以及多组分协同构建无机复合颗粒(J. Mater. Sci. Mater. Med. 2010, 21, 2561-2568.)。由于有机分子对无机晶体结晶的调控,无机晶体粒子展现出不同的多级结构形貌(图1)。
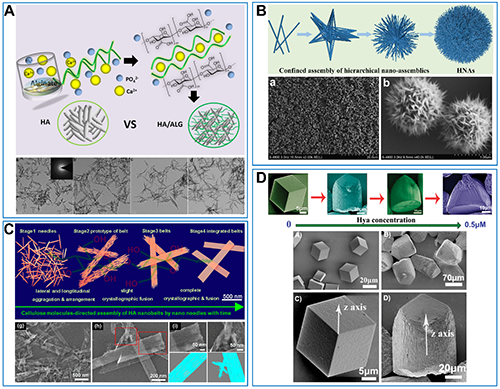
图1. (A)海藻酸钠介导的纳米磷酸钙针状晶体。(B)透明质酸协同受限扩散体系构建的磷酸钙花球晶体。(C)纤维素调控的磷酸钙超薄纳米带。(D)明胶介导的顶状不对称方解石晶体。
在无机晶体的结晶过程中,有机分子不仅调控了无机晶体的形貌,而且还与晶体有效结合,从而构建为无机-有机杂化体。由于有机分子的引入,无机-有机杂化体可以实现更为丰富的化学改性修饰。李教授课题组基于海藻酸钠的仿生矿化体系,构建了海藻酸钠-羟基磷灰石杂化粒子。通过进一步的氧化处理,获得了醛基改性的杂化粒子(OAPs)。通过红外光谱、XRD图谱和热重图谱,证明获得的粒子为具有类骨特征的醛基化海藻酸钠-羟基磷灰石复合粒子。以上结果表明,这种新型的无机材料的构建策略可以有效改善传统无机物改性困难的问题,为新型无机材料的构建提供的新的见解。
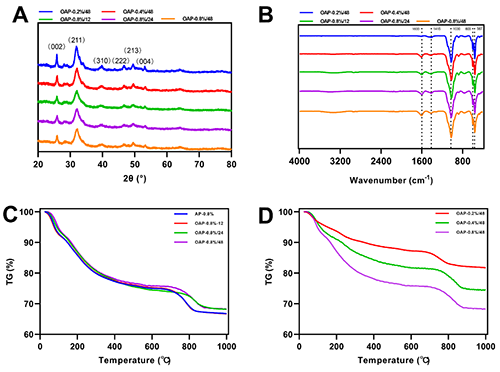
图2. 改性海藻酸钠-羟基磷灰石杂化粒子的(A)XRD和(B)红外图谱。(C)不同氧化时间和(D)不同海藻酸钠含量的OAPs的热重图谱。
基于这种新型的具有化学活性的磷灰石,李教授课题组开发了新型的骨修复材料:
(一)、具有可调模量和应力松弛性能的胶原纤维基质:化学活性磷灰石的双重增强效应(Collagen fibrillar matrices with tunable modulus and stress relaxation: Alginate-activated organoapatite nanoparticles yield dual reinforcement effects. Chemical Engineering Journal. 2025, 517, 164591.)
将化学活性磷灰石引入胶原蛋白基质中,构建了新型的胶原蛋白/磷灰石 (CA)基质。通过OAPs的醛基与胶原蛋白的氨基之间席夫碱交联以及物理钉扎效应,从而增强了胶原蛋白基质的力学性能。如图3所示,OAPs的引入,CA基质展现出明显增强的模量和应力松弛性能。此外,CA基质的力学性能与OAPs的海藻酸钠含量和醛基含量呈现正相关的关系。由此可见,OAPs通过物理和化学双重效应实现了对胶原基质的力学性能的增强。
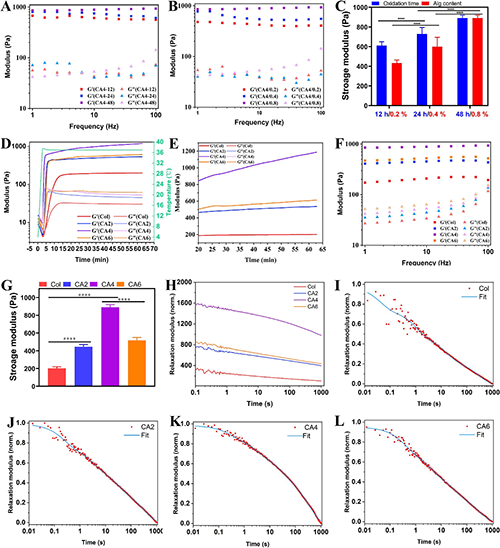
图3. 改性海藻酸钠-羟基磷灰石杂化粒子增强的胶原仿生基质的流变学性质(模量和应力松弛性能)。
流变学结果表明CAs基质在宏观尺度下具有类似于天然组织的粘弹性。然而,细胞对基质特性的感知和反应往往是在微/纳米尺度上进行的。因此,采用纳米压痕仪探究了CAs基质在微观尺度下的力学特性。如图4所示,纯胶原基质的载荷-压痕曲线展现出典型的非线性响应特征,加载和卸载过程存在明显的迟滞现象,证明了其粘弹性和非线性弹性网络。这种应力迟滞现象可能是由于纤维网络的滑移和重新排列造成的。此外,多点模量扫描结果表明,OAPs可以增强CAs基质在微/纳米尺度下的模量和应力松弛性能。
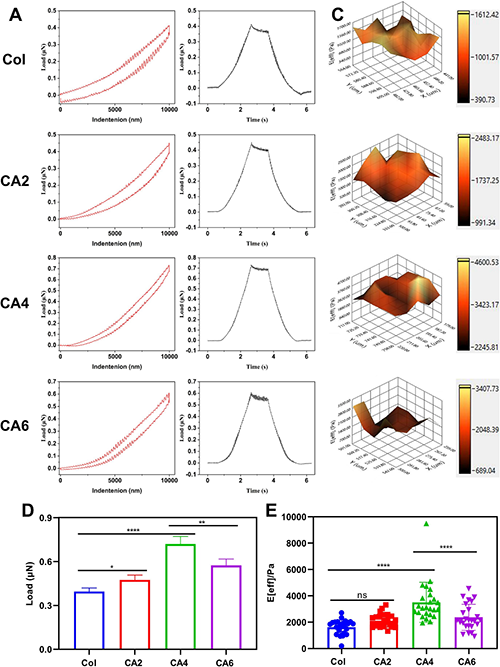
图4. 改性海藻酸钠-羟基磷灰石杂化粒子增强的胶原仿生基质的微/纳米尺度下的力学性质。
通过激光共聚焦显微镜进一步观察了MSCs在CAs基质上培养4天后的铺展形态。其中F-肌动蛋白细胞骨架采用TRITC-鬼笔环肽进行荧光标记,细胞核采用DAPI染色。如图5A所示,在所有基质上,MSCs细胞表面延伸出大量伪足,表明MSCs能够在CAs基质上良好粘附和生长。纯胶原基质上的MSCs细胞呈现典型的多边形立方体形态。在CA2和CA4基质上,MSCs形态趋于细长的纺锤形,并伴随有长丝状伪足的延伸。这种形态改变可能与MSCs的成骨分化进程相关。而在含有最多OAP的CA6基质中,MSCs呈现多边形与纺锤形共存的异质的形态特征,这可能与CA6结构上的不均一性有关。这些实验结果证实CAs基质能够为MSCs的生长提供适宜的微环境。
通过qPCR进一步研究了MSCs在CAs基质上的成骨相关基因表达。如图5B-C所示,相比于纯胶原组,CA2组中BMP的表达略微升高2.4倍。当进一步增加OAPs含量,CA4组中BMP的表达显著上调,比纯胶原组高33倍。然而,相比于CA4组,CA6组中BMP的表达有所下降,但仍比Col组高8倍。这种上调可能是由于CA4具有高的基质模量、快速应力松弛行为以及羟基磷灰石的共同作用[167]。此外,OCN和OPN的表达呈现与OAPs的浓度正相关的趋势(图2.16B和C)。CA4和CA6组中OCN和OPN的表达明显高于其他两组。此外,相比于商用的羟基磷灰石及其制备的胶原复合基质,OAPs和CAs展现出更加优异的促进间充质干细胞成骨分化的能力。
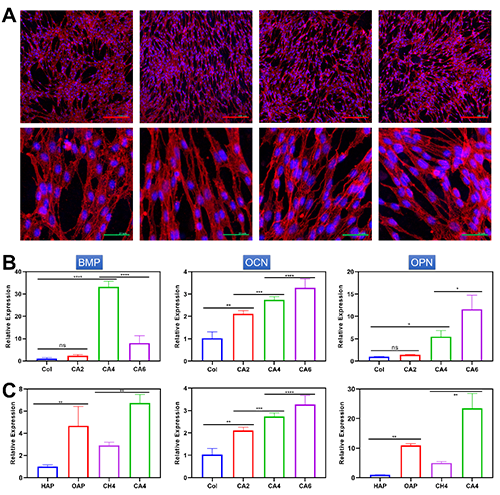
图5. (A)在 CAs 基质上培养 4 天的 MSC 的细胞铺展形态。在具有不同 OAPs 含量的 (B) CA 基质上培养的 MSCs 的成骨基因表达,(C)和商业羟基磷灰石(HAP)、OAP、胶原蛋白/HAP(CH4)和 CA4 基质。
(二)、化学活性磷灰石构建的具有多级适配性的新型骨修复材料(Multilevel Adaptive Monolithic Bone Mimics from Self-Bondable Organoapatite. Composites Part B: Engineering. 2025, 296, 112271.)
羟基磷灰石、生物活性玻璃和硫酸钙等无机材料已被广泛应用于骨缺损治疗。传统无机块体的制备方法通常先将无机材料制成粉末,再通过烧结、水化反应或分散于有机网络中进行固化。然而,受限于复杂的制备流程以及材料性能的不足,新型的制备手段亟待进一步研究开发。近年来,3D打印技术凭借其可控性以及优异的个性化适配性,在构建各种类型的材料方面被广泛的研究和应用。尽管以上方法已实现无机骨修复材料的构建,但面对骨组织工程日益增长的需求,开发具有优异性能的新型无机材料制备策略仍十分必要的。值得注意的是,在生物体内的矿化过程中,矿物质融合形成骨基质往往不需要极端的条件,其在生理条件下就可以高效进行,这与现行无机粉末构建无机块体的加工技术形成鲜明对比。在骨形成过程中,无定形磷灰石前体颗粒首先在胶原蛋白和非胶原蛋白聚糖介导下形成。然后,通过无定形磷灰石前体颗粒的融合实现整体骨基质的构建。
在本研究中,李教授课题组将具有OAPs与羧甲基壳聚糖(CMCS)结合构建了一种新型的骨修复材料(BM)。如图6和视频1所示,BM可以在OAPs和CMCS混合后,再以注射或涂抹的方式到达缺损部位。然后、经过溶胶-凝胶转变,最终无缝地填充各种复杂、不规则的缺损。OAPs可以轻松与CMCS溶液混合形成前驱体。此时,前驱体具有优秀的流动性,可以涂抹或注射进入不规则的形状中,精确地贴合任何精细的几何形状。由于BM具有优异的成型性,其可以实现从毫米级到米级的不同尺度形状的构建。BM不但可以完美模仿形状的大致形貌,而且还可以对其中的多细节的完美复刻。因此,BM可以实现对骨组织工程中不同的缺损进行合适填充。此外,他们在骨骼上构建了不规则缺损,进一步实际研究BM对缺损的填充作用。如图所示,结果表明,BM能够有效地填充不规则缺损并恢复骨完整性,在骨组织工程领域具有巨大应用潜力。此外,得益于席夫碱反应的可逆性,BM还具有自愈合能力。将断开的BM拼接在一起后,其能够重新整合成一个整体。
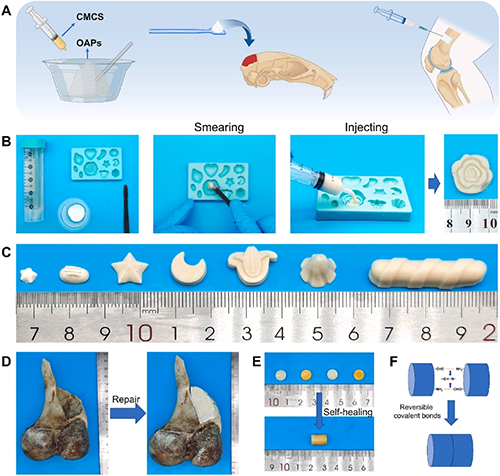
图6. (A)BM的操作性、可注射性和形状适应性的示意图。(B)BM操作及使用方法的图片。(C)基于BM,构建的不同尺寸的精细形状材料的数码图片。(D)BM填充骨缺损的数码照片。(E)BM的自愈性图像和(F)示意图。
骨骼在生物体内发挥着重要支撑作用,其维持着生物体的稳定。机械支撑对治疗骨缺损的骨科材料至关重要,其中抗压强度是关键参数之一。因此,我们采用万能试验机研究了BM的抗压性能。如图7所示,在0 – 20 %,BM-31展现出弹性形变过程,应力-应变呈线性相关的关系。当应变到达21.2 %时,应力到达最大值后迅速下降,表明材料发生破损失效。对于BM-32和BM-33,应力-应变曲线与BM-31相似。此外,我们对不同BM的抗压强度进行了统计。BM-31的抗压强度约为0.61 MPa。 随着OAP-3含量的增加,BM-32的抗压强度提升至1.01 MPa。 值得注意的是当进一步增加OAP-3的含量,BM-33展现出出色的抗压强度,可以达到2.15 MPa。这已经远远超出传统可注射氧化海藻酸钠水凝胶的强度,已经接近磷酸钙骨水泥的性能。 此外,BM的弹性模量也与OAP-3含量呈正相关的关系。其中,BM-33的弹性模量约为10.19 MPa。

图7. (A)BM-31, (B)BM-32 and(C) BM-33 (Φ = 6 mm, h=12 mm)的应力-应变曲线,及(D)抗压强度和(E)弹性模量的统计数据。
为了进一步研究与成骨相关的基因表达的变化,进行了转录组 mRNA 测序分析。如图8所示,与对照组相比,BM 表现出 1094 个基因的显著上调和 1048 个基因的下调。基因表达热图显示,成骨细胞和破骨细胞分化相关关进基因表达的增强,例如Tnn、Tgfa、Fgf1、Vegfc、Wnt5a、Bmp2、Il20rb 和 Fosl1。KEGG 富集分析表明 Wnt 信号通路、钙信号通路、PI3K-Akt 信号通路、Ras 信号通路和 JAK-STAT 信号通路的富集,表明 BM 在促进 MSCs 成骨分化的潜力。此外,生物过程的 GO 富集分析显示细胞粘附、炎症反应、细胞因子产生和血管发育相关生物过程的分析。此外,BM可以调节细胞成分和分子功能,包括“受体复合物、质膜外侧、细胞表面、细胞因子活性、抗氧化活性、生长因子受体结合和细胞因子受体结合”,从而介导 MSC 的成骨分化。以上结果证明,BM 可以促进成骨分化的基因表达和信号通路,从而可能促进骨骼的形成和重建。
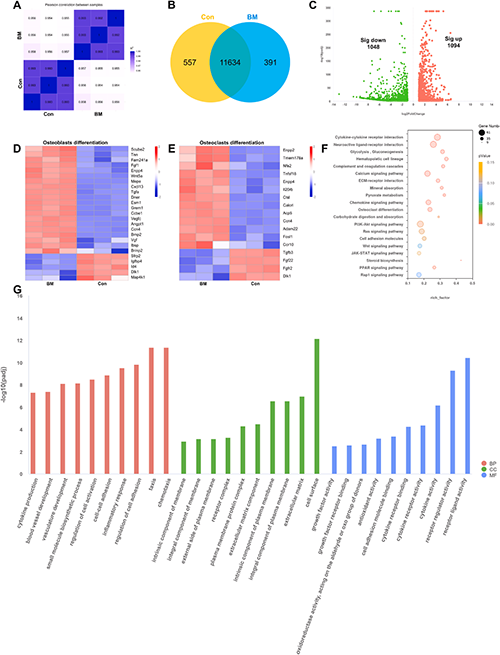
图8. (A) 主成分分析。(B) 总差异基因的维恩图。(C) 差异表达基因的火山图。(D) 成骨细胞分化和 (E) 破骨细胞分化相关的差异表达基因的热图分析。(F) KEGG 和 (G) 信号通路的 GO 富集分析。
通过大鼠颅骨缺损修复实验进一步验证BM的骨修复能力。如图9所示,BM可以有效促进颅骨缺损的修复。此外,不同交联度的BM展现出不同的体内降解性,表明BM具有实现“降解-再生”匹配的潜力。H&E染色分析进一步确认了新生骨组织的形成。免疫组化和免疫荧光染色分析表明,BM可以有效提升RUNX2、OPN、OCN、ALP和OST的表达,从而促进新生骨组织的形成。
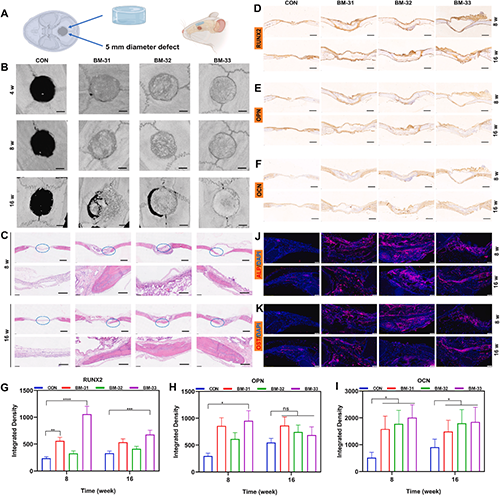
图9.颅骨缺损 (5 mm)修复动物实验。(A) 颅骨缺损修复实验的示意图和实验安排表。(B)手术后 4 、 8 和 16 周颅骨的 micro-CT 图像。比例尺为 1.5 毫米。(C) 脱钙切片的 H&E 染色。比例尺为 1 mm 和 200 μm。脱钙颅骨切片的(D, G) RUNX2、(E, H) OPN 和 (F, I) OCN 的免疫组织化学染色和定量分析。
采用临界颅骨缺损(8 mm) 以进一步研究 BM-33 在体内的长期效果。通过连续的显微 CT 监测用相同样本的颅骨缺损修复进程和材料的降解情况。如图10所示,对照组随时间没有明显变化。在前三个月,BM-33组颅骨和材料几乎没有变化。第4个月时,BM 的边缘开始轻微降解,伴随着 BM-33材料表面出现高密度物质。第8个月时,高密度新生骨组织几乎完全覆盖了材料。H&E染色进一步确认了新生骨组织的形成。通过TRAP染色进一步分析破骨细胞活性在骨再生过程中的表现。在整个实验周期内,对照组均见明显的TRAP活性,表明未发生破骨活性。对于BM-33,第4个月时同样未见破骨细胞活性。第8个月时,材料与组织接触的部位出现明显的TRAP阳性,表明此时破骨细胞活性增高。这可能与BM-33在不同阶段的降解情况有关。前4个月材料处于与宿主组织融合阶段,降解速率较缓,未能引发破骨细胞响应。随着材料与组织融合降解,从而促进破骨活性的产生。此外,破骨活性的不同与新生骨形成进程具有相关性。在实验后期,材料降解后,通过激活破骨细胞活性进而启动“破骨-成骨”偶联,从而促进了骨修复,这与后期新骨的大量形成的实验现象一致。

图10. 临界颅骨缺损 (8 mm) 修复动物实验。(A)动物实验的示意图。(B) 术后 1、2、3、4、5、6、7 和 8 个月颅骨的显微 CT 图像。比例尺为 1 mm。HB 表示宿主骨。NB 表示新骨。FT 表示纤维组织。M 表示 BM-33 的材料。(C)未脱钙切片的 H&E 染色和(D)颅骨的 TRAP 染色。黑色和红色比例尺分别为 1 mm 和 0.5 mm。(E) BM 通过上调成骨相关因子的表达来形成成骨能力。
原文链接:
https://www.sciencedirect.com/science/article/abs/pii/S1385894725054270
https://www.sciencedirect.com/science/article/abs/pii/S1359836825001611
- 东华大学廖耀祖/吕伟课题组 Chem. Sci.:铜介导双极性卟啉基CMP协同优化孔道结构与电化学活性用于高容量快充锂离子电池 2025-05-24
- 山东大学崔基炜/王连雷教授《ACS Nano》:骨“创可贴”用于骨质疏松性骨折修复 2025-12-07
- 华东理工刘润辉教授课题组 AFM:基于仿生有机-无机互穿网络的增强型微球用于骨修复 2025-11-04
- 浙江大学赵玥绮团队 AFM: 仿生梯度结构水凝胶助力骨软骨修复 2025-10-15
