近年来,负载干细胞的3D支架作为组织工程构建物为代替和修复受损组织(如皮肤、骨/软骨、脊髓等)提供了一种极具前景的解决方案。该组织工程构建物的广泛应用依赖于干细胞的高效低温保存,但其仍面临以下挑战:1)干细胞在低温保存时,需使用有毒冷冻保护剂(如DMSO)以抑制冰晶损伤;2)解冻复苏后,需要进行复杂的洗脱步骤以去除这些有毒保护剂;3)解冻后的干细胞通常需要整合至3D支架中以便后续的组织工程应用。因此,开发一种基于3D支架的干细胞低温保存平台,并消除有毒冷冻保护剂的使用,提供“现货型”组织工程构建物变得越来越重要。
近日,郑州大学生命科学学院睢晓洁副教授提出了一种新型的干细胞低温保存平台。该平台通过联合聚乙烯吡咯烷酮/结冷胶/明胶(PGG)抗冻支架包封策略和L-脯氨酸诱导的细胞预脱水策略,实现了干细胞的高效低温保存(复苏存活率达95%),且避免了传统有毒冷冻保护剂(如DMSO)的使用。在解冻复苏后,包封小鼠骨髓间充质干细胞(BMSCs)的PGG抗冻支架可作为组织工程构建物(BMSCs@PGG)直接应用于小鼠皮肤急性损伤修复,促进伤口愈合,为实现干细胞的高效保存和便捷应用提供了新思路。
相关研究成果以“An Antifreezing Scaffold-based Cryopreservation Platform of Stem Cells for Convenient Application in Wound Repair”为题发表在《Advanced Healthcare Materials》杂志上。
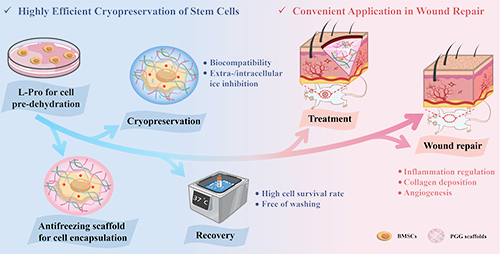
图1. 便捷用于伤口修复的干细胞低温保存平台示意图
1. PGG抗冻支架的制备与表征
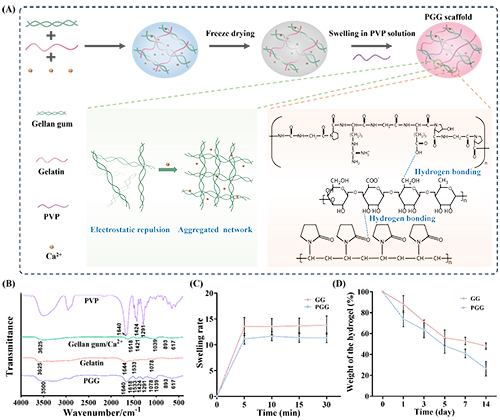
图2. PGG抗冻支架的制备与表征

图3. PGG支架抗冻性能的表征
2. L-脯氨酸诱导细胞预脱水
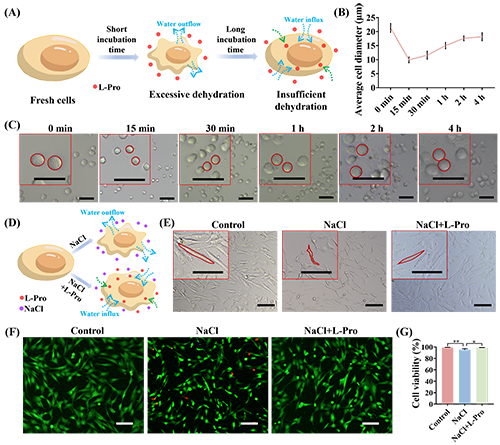
图4. L-脯氨酸诱导的细胞预脱水
3. 低温保存平台的构建
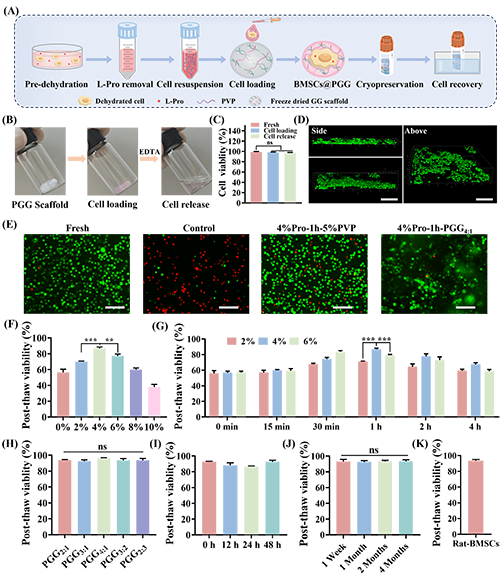
图5. 低温保存平台的构建
4. 生物相容性测试

图6. 生物相容性测试
5. 解冻后干细胞的体外功能评估
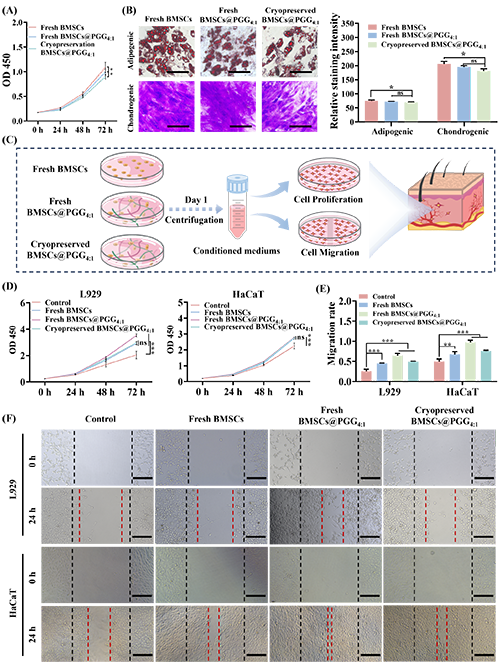
图7. 解冻后干细胞体外功能的评估
6. 解冻后的BMSCs@PGG作为组织工程构建物用于伤口修复
进一步地,作者构建了小鼠皮肤急性损伤模型,以评估解冻后BMSCs@PGG4:1作为组织工程构建物在皮肤再生中的应用效果(图8A)。如图8B,C所示,新鲜BMSCs@PGG4:1组和冻存BMSCs@PGG4:1组伤口愈合速度与空白对照组相比明显加快。治疗后第14天,皮肤H&E染色图像显示,新鲜BMSCs@PGG4:1组和冻存BMSCs@PGG4:1组炎症细胞浸润减少,成纤维细胞增加,并伴有伤口区域新血管结构的形成(图8D)。此外,相比于空白对照组和新鲜BMSCs组,新鲜BMSCs@PGG4:1组和冻存BMSCs@PGG4:1组第14天的新生皮肤具有较薄的表皮(图8F)、较少肉芽组织(图8G)、更完整的真皮(图8H)以及更多的胶原沉积(图8E,I)。


图9. 第14天创面皮肤组织的免疫荧光染色。
综上,作者构建了一种新的BMSCs低温保存平台,该平台通过使用PGG抗冻支架以抑制细胞外冰晶的形成,并联合L-Pro诱导的细胞脱水策略以最大程度的减少细胞内冰晶的形成,最终实现了干细胞的高效低温保存,且摒弃了传统有毒保护剂的使用。由于PGG支架的优异生物相容性和独特的3D结构,解冻后的BMSCs@PGG不用进行任何洗涤过程,可以直接作为组织工程构建物用于治疗小鼠皮肤急性损伤。
原文链接:https://doi.org/10.1002/adhm.202404228
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 华南理工朱伟、广东省人民医院陈洪林 ACS Nano:界面硅化“点石成骨” - 无需诱导因子精准驱动干细胞成骨分化 2025-07-20
- 东南大学张天柱教授团队《ACS Nano》:封装脂肪干细胞外泌体补片用于调节炎症和促进组织再生 2025-06-09
- 苏州大学邢铁玲/陈国强教授团队 CEJ: 植物源咖啡酸诱导棉织物表面银纳米线生长及其可穿戴应用 2023-07-14
- 广东工业大学闵永刚/黄锦涛团队和冯星课题组 ACHM:利用静电纺丝制备含芘基AIE分子的复合相变纤维及其多功能应用 2023-07-09
- 川大杨成/伍晚花课题组:锂藻土/聚乙烯吡咯烷酮纳米复合材料在固相中实现绝对量子效率高达23.8%的TTA上转换发光应用于信息防伪 2022-10-13
- 浙大王立教授/俞豪杰教授团队Carbohyd. Polym.:用于促进伤口愈合和骨再生的多巴胺功能化硫酸软骨素/明胶基复合水凝胶 2025-07-26
