创伤性脑损伤(TBI)可导致危及生命的永久性残疾。由于神经元再生能力有限,目前尚缺乏有效的治疗方法。神经干细胞(NSCs)可分化为功能完整的神经元重塑神经环路,因此被视为修复脑损伤的潜在工具。然而,其分化效率低、速度慢制约了治疗效果。近些年的研究表明,电刺激不仅能够调控神经活动,还可促进NSCs向功能神经元分化,修复神经网络。然而,传统电刺激需通过植入电极导线实现,会造成二次损伤、免疫排斥和感染,严重阻碍其临床应用。如何实现安全无创的高效电刺激,成为NSCs疗法临床转化的核心挑战。压电纳米材料在超声刺激下发生形变可产生表面压电电势,这种特性为细胞和组织的无线原位刺激提供了新型技术途径。此外,由于超声波具有优异组织穿透能力,该技术特别适用于深部组织的无创细胞命运调控。然而,研究团队在实验中发现,钛酸钡(BTO)压电纳米颗粒极易被神经干细胞内吞并富集在溶酶体中,所以其在超声激活下产生的压电电势无法精准刺激到细胞膜表面的电压门控受体。此外,在溶酶体酸性环境中,产生压电电势不仅无法应用于细胞膜,反而产生了大量活性氧类物质(ROS),引发细胞毒性并导致神经干细胞死亡。为压电纳米颗粒介导的无线电刺激在基于干细胞的神经修复疗法中的应用蒙上了一层阴霾。
针对上述问题,山东大学晶体材料全国重点实验室仇吉川教授、刘宏教授和桑元华教授联合齐鲁医院神经外科李刚教授、基础医学院易凡教授,基于材料-细胞相互作用规律,开发了一种可以长期锚定于神经干细胞膜上的钛酸钡-还原氧化石墨烯(BTO/rGO)复合压电纳米贴片,在超声刺激下可持续产生压电电位。本研究中,产生压电电位的核心为四方相的BTO纳米颗粒,而还原氧化石墨烯(rGO)纳米片可以锚定在NSC细胞膜表面,随细胞一起动态迁移,在超声驱动下,压电纳米贴片产生的压电刺激直接作用于细胞膜电压门控钙离子通道(VGCC),激活钙调蛋白依赖性蛋白激酶Ⅱ(CaMK II)/环磷酸腺苷反应元件结合蛋白(CREB)信号通路,显著提高了神经干细胞向神经元分化的效率和成熟速度,促进形成了具有生物功能的神经元网络。同时该压电纳米贴片可以避免被细胞内吞,避免了溶酶体内ROS的产生及其引起的细胞死亡。实现了高效安全的无线电刺激。
锚定有压电纳米贴片的NSCs可以直接微创移植到大鼠创伤性脑损伤区域。经过每两天一次的超声治疗,植入的NSCs可以分化为功能神经元,显著提高了损伤处神经元的数量和密度。28天后可有效促进损伤脑组织修复,促进创伤性脑损伤大鼠的运动协调性与认知功能恢复。该压电纳米贴片及相关治疗创新技术在治疗神经损伤和神经退行性疾病等方面具有重要应用前景。

相关成果以“Ultrasound-activated piezoelectric nanostickers for neural stem cell therapy of traumatic brain injury”为题,于2025年5月6日发表于Nature Materials。晶体材料全国重点实验室与齐鲁医院联合培养博士生王文晗,晶体材料全国重点实验室博士生李克熠为本文共同第一作者。该成果同时受邀被Nature Materials以“Extracellular piezoelectric nanostickers promote neuronal differentiation”为题撰写Research Briefing进行亮点报道。
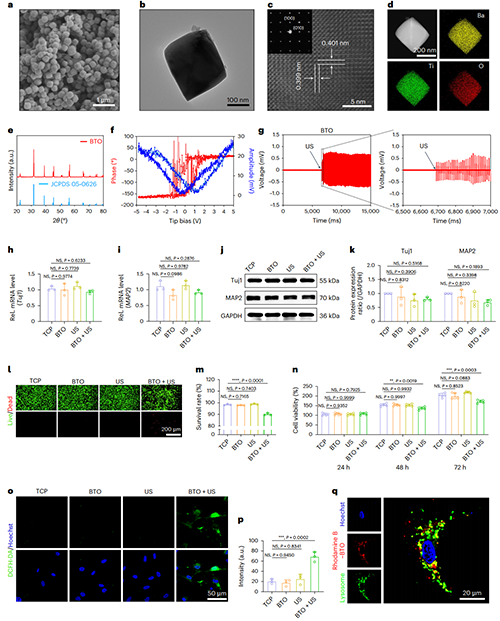
图1. BTO纳米颗粒无法促进NSCs的神经分化
图1展示了BTO纳米颗粒的形貌(图1a-d)、物相分析及压电特性(图1e-g)。在超声(US)处理下,神经元相关标志物(Tuj1和MAP2)在基因和蛋白水平上与空白对照组相比无显著性差异(图1h-k)。生物相容性证明BTO+US处理造成了NSCs的死亡,抑制了其增殖活力(图1l-n)。进一步研究表明,BTO+US处理后NSCs中产生的大量ROS是引起细胞毒性的主要原因(图1o)。材料与溶酶体共定位染色进一步佐证了这一观点(图1q)。
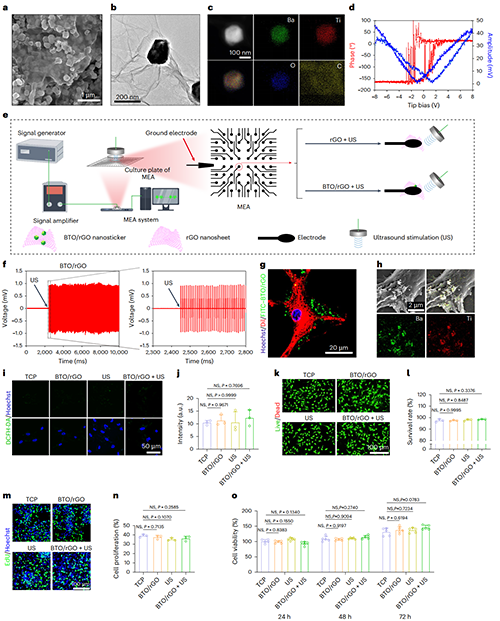
图2. BTO/rGO压电纳米贴片表征及生物相容性检测
为解决这一问题,研究团队通过化学键合将BTO纳米颗粒负载于还原氧化石墨烯(rGO)纳米片表面,成功制备出具有优异压电性能的BTO/rGO复合纳米贴片。图2展示了压电纳米贴片的形貌及压电特性(图2a-f)。材料-细胞相对位置荧光染色及EDS模式下的扫描图像证实了该压电纳米贴片可锚定于NSCs细胞膜表面(图2g-h)。ROS染色证实,与空白对照组相比,在BTO/rGO+US处理下,NSCs内未产生活性氧。成功避免了ROS对细胞的毒害作用(图2i-j)。生物相容性检测证实了BTO/rGO+US处理未造成细胞的过度死亡(图2k-l)。NSCs的增殖活性也未受影响(图2m-o)。
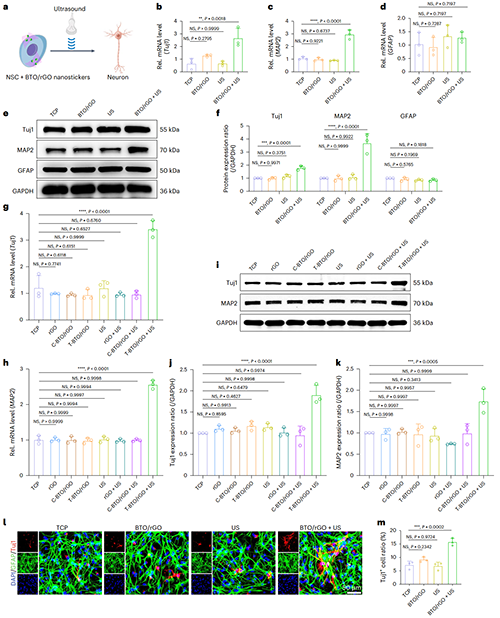
图3. 超声响应BTO/rGO压电纳米贴片压电刺激促进NSCs的神经分化
图3展示了经过BTO/rGO+US处理后的NSCs在基因和蛋白水平上显著提高了Tuj1和MAP2的表达(图3b-f)。通过添加对照试验组,证明了NSCs神经分化的诱因是压电纳米颗粒(四方相钛酸钡:Tetragonal BTO)而非rGO纳米片等非压电相关因素(图3g-k)。免疫荧光染色结果证明BTO/rGO+US处理显著提高了NSCs向神经元的分化比例(图3l-m)。
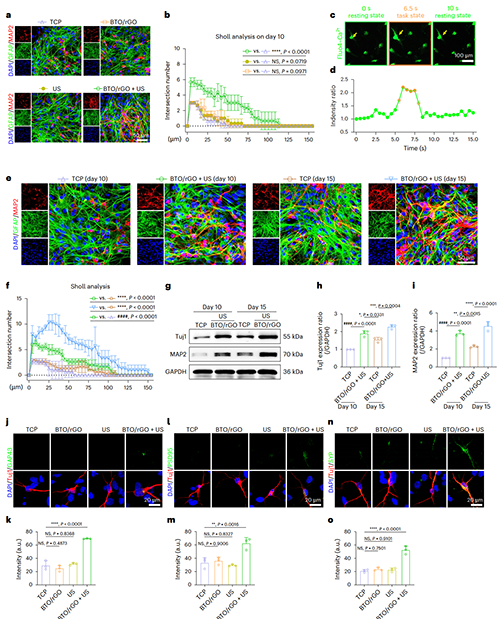
图4. 压电刺激加速NSCs向神经元的分化进程
图4a-b显示了BTO/rGO+US处理10天后,分化的神经元的轴突延伸长度及突起数量显著提高。钙火花现象(图4c-d),证明该神经元具有响应神经递质的功能。进一步的研究表明,BTO/rGO+US处理10天组的神经元轴突长度及突起数量高于自发分化15天的神经元(图4e-f),且10天处理组的Tuj1及MAP2蛋白水平显著高于15天自然分化组(g-i),证明压电刺激可使NSCs分化为成熟神经元的进程提前5天。突触相关蛋白免疫荧光染色证明BTO/rGO+US处理后分化的神经元具有形成突触连接的能力(图4j-o),这对于神经网络的重构至关重要。
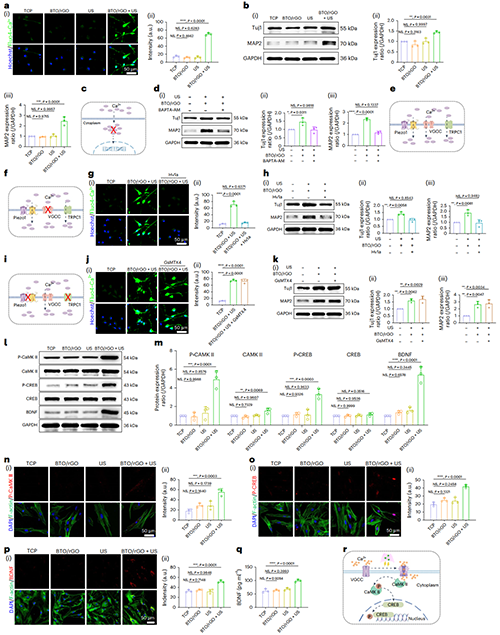
图5. 压电刺激促进NSCs神经分化信号转导机制
图5显示了BTO/rGO+US处理后NSCs内钙离子含量显著升高,证明NSCs向神经元的分化进程与胞内钙离子含量具有密切关联(图5a-b)。在设置钙离子胞内拮抗剂及几种相关钙离子通道抑制剂对照组后,我们证明了BTO/rGO+US压电刺激通过直接作用于VGCC,启动胞内CaMK II/CREB信号通路,最终启动靶基因脑源性神经营养因子(BDNF)的表达,促进神经干细胞向神经元的分化(图5c-r)。
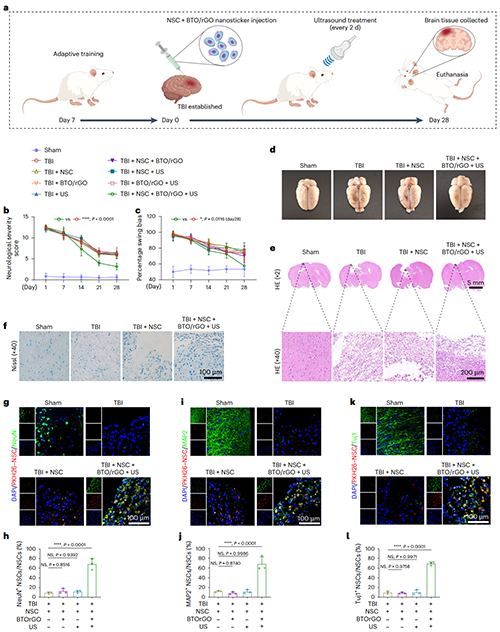
图6. NSCs移植联合超声响应BTO/rGO压电纳米贴片压电刺激治疗TBI
示意图展示了进行TBI建模到NSCs移植联合超声治疗的全过程(图6a)。大鼠接受每两天一次的超声治疗,28天后治疗组大鼠运动功能及身体协调能力明显恢复(图6b-c)。组织化学染色显示治疗组大鼠缺损的脑组织被新生组织填充(图6e-f)。对组织切片进行免疫荧光染色,治疗组大鼠的脑缺损部位显示出密度更高的神经元(图6g-l)。充分证明了压电纳米贴片在超声作用下产生的压电刺激有效促进了移植的NSCs向功能神经元的分化,促进了受损组织的神经功能整合。改善了TBI大鼠的神经功能。该压电纳米贴片及相关治疗创新技术在治疗神经损伤和神经退行性疾病等方面具有重要应用前景。
该项研究基于材料-细胞相互作用设计了一种钛酸钡-还原氧化石墨烯复合压电纳米贴片。该贴片能够锚定在干细胞膜上,并将压电信号精准作用于膜上的电压门控钙离子通道,而不诱导活性氧类物质的产生。超声响应的压电纳米贴片可促进移植的神经干细胞向神经元分化,提高创伤性脑损伤的治疗效果。本研究揭示了不同亚细胞定位的压电刺激会对细胞行为和功能产生不同影响,为研究材料-细胞相互作用开辟了新的途径。
文献信息
Wang, W., Li, K., Ma, W. et al. Ultrasound-activated piezoelectric nanostickers for neural stem cell therapy of traumatic brain injury. Nat. Mater. (2025).
https://doi.org/10.1038/s41563-025-02214-w
- 中科院上海硅酸盐所刘宣勇团队 Mater. Today:基于压电增强动电效应的超声响应水凝胶促进神经血管再生加速糖尿病创面愈合 2025-02-24
- 福州大学黄达/南科大吴德成 AHM:集成pH探针和超声响应性微囊的可注射水凝胶用于伤口可视化监测和按需治疗 2024-01-16
- 浙江大学周民团队/叶娟团队《Biomaterials》:超声响应性复合纳米材料用于治疗脉络膜黑色素瘤的研究 2024-01-10
- 吉大林权教授、吉大第二医院杨小玉教授《Mater. Today》:仿生3D软支架结合电刺激调控神经干细胞分化引导脊髓损伤修复 2023-12-02
- 苏州纳米所张智军研究员团队 CEJ:负载神经干细胞3D打印导电神经支架显著改善脊髓损伤修复效果 2022-08-29
- 中科院苏州纳米所张智军研究员团队《Mater. Sci. Eng. C》:生物3D打印导电水凝胶支架调控神经干细胞定向分化 2022-01-13
- 暨南大学郭瑞研究员团队 AFM:一种新型3D打印双层颅-脑补片用于同时治疗创伤性脑损伤和颅骨缺损 2024-01-24
