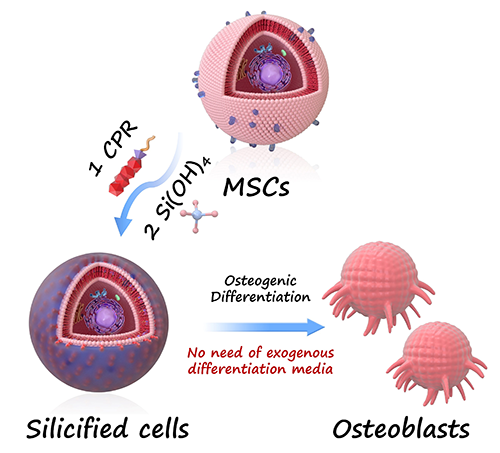
间充质干细胞(MSCs)因其多向分化潜能,被广泛应用于骨组织工程与再生医学领域。当前主流的成骨诱导策略,普遍依赖骨形态发生蛋白(BMP-2)、地塞米松等外源成骨因子配合特定培养基,但此类方法存在成本高、副作用强、体内效应不稳定等难题,严重制约了其临床转化。如何在无外源诱导因子参与的条件下,实现高效、稳定的成骨分化,成为干细胞应用研究的一大挑战。
近日,华南理工大学生物科学与工程学院朱伟教授团队与广东省人民医院陈洪林副教授团队联合,提出了一种全新的“界面硅化(Interfacial Silicification)”策略:通过人工设计的两亲性肽分子,在细胞膜表面原位催化硅前驱体沉积,直接诱导MSC分化为成骨细胞。该策略不仅完全摆脱了传统成骨诱导培养体系的依赖,更在多种来源的MSC中展现出稳定、通用的诱导效果。相关成果以“Interfacial Silicification Efficiently Drives Osteogenic Differentiation of Mesenchymal Stem Cells without Any Exogenous Osteoinductive Factor”为题,发表在国际顶级期刊《ACS Nano》上。
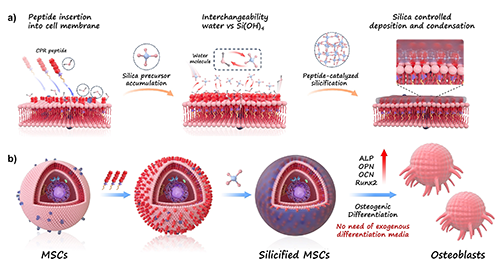
图1. CPR肽驱动的界面硅化诱导MSC成骨分化示意图。a)CPR肽嵌入MSC细胞膜,通过亲疏水协同作用促使硅前驱体在细胞表面聚集并沉积;b)在无外源成骨诱导因子的条件下,经界面硅化处理后的MSC成功诱导分化为成骨细胞。
为实现无因子驱动的成骨诱导,研究团队设计出一种功能性两亲性多肽(CPR肽),其包含三个关键结构域:N端棕榈酸链用于锚定细胞膜、中央PEG间隔臂提升亲水性与生物相容性,C端则引入源于硅藻肽的RRIL序列,具备高度亲硅活性。该肽可自组装插入MSC细胞膜,通过调控细胞界面与硅前驱体(如TEOS水解产物Si(OH)?)的动态交换,实现细胞膜原位硅沉积。
这一“界面硅化”过程有效改变了MSC的表面微环境,并引发一系列信号传导变化,包括成骨相关因子(RUNX2、OPN、OCN等)的显著上调,最终促进MSC向成骨细胞表型的转化。更重要的是,这一过程完全无需传统诱导培养液,展现出优异的通用性与操作简便性。
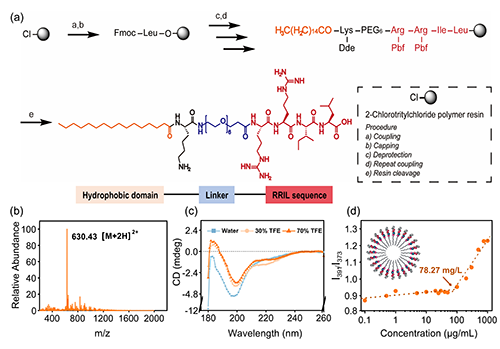
图2. CPR功能肽的合成与结构表征。a)CPR肽的合成流程图;b)ESI质谱验证了肽链分子量的准确性;c)圆二色谱揭示其在疏水环境中趋向形成α-螺旋构象;d)通过荧光探针法测定其CMC为78.27 mg/L,显示其良好的自组装能力。
为了实现“界面催化沉积”的设计构想,研究团队采用固相合成策略构建了CPR肽分子,其结构包括棕榈酸疏水基、PEG?亲水间隔段和具有强硅亲和力的RRIL功能序列。通过质谱检测(ESI-MS),验证了合成肽的分子量准确、结构纯净;圆二色谱(CD)进一步揭示其在水相中呈现无序构象,而在疏水环境中诱导α-螺旋结构的形成,模拟了其在细胞膜嵌入状态下的构象转变。
此外,荧光探针和CMC(临界胶束浓度)测试显示,CPR肽具备良好的自组装能力,可稳定聚集于膜表面,形成有序排列,为硅前驱体的吸附与聚合提供理想的催化微环境。这些结果共同验证了该功能肽在界面硅化策略中的关键作用。
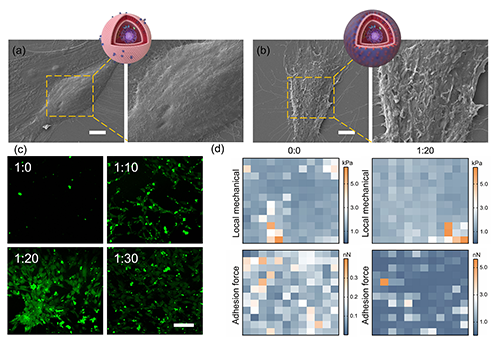
图3. 界面硅化后MSC表面结构及力学性能变化。a–b)SEM展示了MSC与硅化后细胞表面的结构对比,硅化组(1:20)呈现明显颗粒沉积;c)共聚焦显微镜显示TEOS沉积随CPR浓度增强而累积(绿色荧光);d)AFM热图揭示硅化处理后细胞局部刚度与黏附力均显著升高。
为了验证CPR诱导的“界面硅化”是否真实发生于细胞表面,研究团队使用扫描电子显微镜(SEM)和原子力显微镜(AFM)对MSC进行形貌与力学表征。未处理细胞表面光滑,而硅化处理后细胞表面出现粗糙颗粒状结构,明确提示有无机壳层沉积。AFM测定也显示,硅化细胞的杨氏模量和黏附力均明显上升,表明细胞膜结构发生实质性变化。
进一步借助FITC标记的硅前驱体染色和荧光显微镜观察,不同CPR/TEOS比例组中均观察到绿色荧光增强,且1:20与1:30组最强,说明在最佳比例下,CPR能显著促进硅在细胞表面的聚集沉积。
这些结果不仅直观展示了“界面硅化”的发生过程,也揭示其对细胞表面生物力学特性(刚度、附着力等)的影响,为后续成骨分化的发生提供了结构和物理基础。
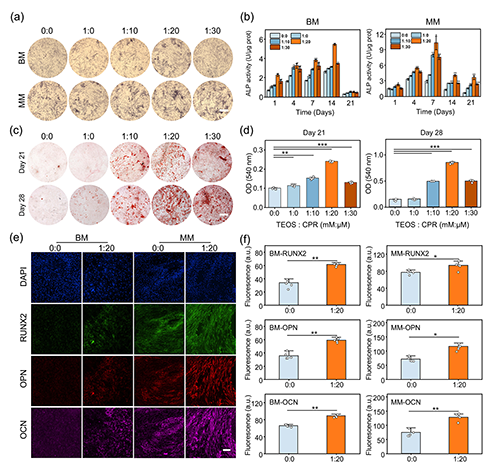
图4. 界面硅化显著促进MSC成骨分化。a–b)ALP染色与活性定量结果显示,CPR+TEOS处理组在无诱导因子的BM条件下仍表现出显著成骨启动能力;c–d)茜素红染色及定量结果揭示矿化水平同步提升;e–f)免疫荧光显示RUNX2、OPN与OCN表达增强,进一步证实细胞向成骨方向分化。
为了验证界面硅化策略在生物功能层面的实际成效,研究团队对MSC成骨分化的全过程进行了系统评价。在未添加任何外源成骨因子的基础培养条件(Basal Medium, BM)下,CPR+TEOS处理组在第7天即显示出显著的碱性磷酸酶(ALP)活性增强,尤其是1:20配比组染色最深,活性提升近两倍,显示出优异的早期成骨潜能。
在矿化阶段,茜素红染色结果(第21天和第28天)显示1:20组钙盐沉积最为显著,呈现大面积红色结晶,反映了后期骨基质形成能力的增强。进一步的免疫荧光染色与RT-qPCR分析也表明:成骨相关蛋白(RUNX2、OPN、OCN)表达显著上调,且分布呈特异性核/胞定位,印证了MSC在界面硅化引导下成功进入成骨分化通路。
值得注意的是,这一效应在无任何成骨培养基的条件下依然稳健存在,且多种来源MSC(包括hBMSC和hUMSC)均可复现这一分化趋势,凸显其广泛的适应性与转化潜力。
以上相关成果以“Interfacial Silicification Efficiently Drives Osteogenic Differentiation of Mesenchymal Stem Cells without Any Exogenous Osteoinductive Factor”为题,发表于国际权威期刊《ACS Nano》上。
本研究首创性地提出了一种无需任何外源诱导因子的干细胞成骨分化策略——界面硅化(Interfacial Silicification),通过设计一类功能性两亲肽,在MSC细胞膜表面引导硅前驱体原位聚合沉积,显著增强细胞黏附性、机械强度与骨向分化能力。该方法在鼠源、人骨髓及脐带MSC中均表现出稳定诱导效果,具备广泛的适用性与转化潜力。
相比传统依赖培养基与生长因子的成骨诱导方式,界面硅化策略不仅降低了操作复杂度与成本,更显著提升了安全性与可控性,为未来无因子细胞工程与骨组织再生技术的发展提供了全新思路。
该论文第一作者为华南理工大学生物科学与工程学院硕士研究生田周萍,通讯作者为华南理工大学生物科学与工程学院朱伟教授和广东省人民医院陈洪林副教授。
该研究得到了国家自然科学基金、广东省珠江人才计划、广东省引进创新创业团队计划、广东省重点领域研发计划等项目的支持。
原文链接:https://pubs.acs.org/doi/full/10.1021/acsnano.5c01628
- 香港城大胡金莲教授团队 AFM:聚偏二氟乙烯静电纺丝纳米纤维对干细胞成骨分化的调节 2023-11-01
- 华南理工大学边黎明教授课题组《Nat. Commun.》:超结构动态水凝胶促进干细胞在三维环境中的力学传感与分化 2021-06-17
- 西安交通大学雷波课题组在miRNA递送调控干细胞成骨分化领域取得进展 2016-10-28
