近日,中比先进生物医用材料联合实验室(南京林业大学-根特大学)熊燃华教授,Stefaan C. De Smedt院士及Kevin Braeckmans教授在Nature Communications上在线发表了题为“Light triggered nanoscale biolistics for ef?cient intracellular delivery of functional macromolecules in mammalian cells”(DOI: 10.1038/s41467-022-29713-7)的研究型论文。他们开发了一种新型纳米粒表面荷载纳米弹丸的“纳米炸弹”,揭示了其与光协同生成纳米微泡“推动”生物大分子进入胞内的高效递送机制,显著提高了大粒径生物大分子(如mRNA、pDNA)的递送效率,实现了高通量、高效的胞内递送。中比先进生物医用材料国际联合(南京林业大学-根特大学)实验室熊燃华教授、Stefaan C. De Smedt院士和Kevin Braeckmans教授为通讯作者。

向活细胞内递送功能生物大分子是生物医学领域的一个重要研究方向,例如,细胞免疫疗法需要在体外通过胞内递送技术,将生物大分子如核酸等递送到细胞内,得到功能免疫细胞;然后将其回输到患者体内,实现免疫细胞对癌细胞产生特异性识别,达到精准杀伤癌细胞的目的。然而,生物大分子向胞内递送过程需要克服细胞膜造成的系列障碍如细胞摄取、胞内释放等。传统的胞内递送方法难以兼顾细胞处理通量、递送效率、递送安全等问题。因此,如何创建高通量、高效、安全的生物大分子胞内递送新材料及技术是需要解决的关键科学问题,对生物医学领域的发展具有重要的意义。
光作用的胞内递送方法具有较好的通用性和调控性,尤其适用于在离体情况下递送各种生物大分子到各类细胞内。将激光束聚焦于细胞膜,可在细胞膜上短暂地形成微小膜孔,生物大分子通过膜孔自由扩散进入胞内,实现胞内递送过程。然而,如何将光束“手动”聚焦到仅有几纳米厚的细胞膜上,并形成几百纳米范围的膜孔异常困难,实验操作的复杂性极大限制了细胞处理通量和该方法的进一步应用。为了解决这一难题,他们提出了纳米粒与光协同增强胞内递送的方法,通过黏附在细胞上的纳米粒将光协同效应“自动”聚焦于细胞膜,进行高通量的快速精准“开孔”,局部增强细胞膜渗透性,将细胞处理通量从每分钟数十个显著地提高到每分钟百万个,实现了高通量的胞内递送。他们利用具有良好细胞黏附能力的阳离子聚合物与光吸收功能较好的纳米颗粒(如纳米金、石墨烯量子点、黑磷量子点等)之间的相互吸附效应,制备了一系列改性光吸收纳米颗粒。首先,将阳离子聚二烯二甲基氯化铵修饰在金纳米颗粒表面,制备了具有良好细胞黏附性的金纳米粒;发现在强激光能量密度协同作用下,金纳米粒迅速吸收光能转化成热能,诱导生成纳米微泡并在细胞膜上高通量地快速精准“开孔”,细胞外的生物大分子通过“膜孔”渗透到细胞内,从而实现胞内递送过程。该递送策略不仅保障了细胞的高通量处理,而且将小干扰核酸(siRNA)递送效率从传统热作用的40%提高到80%,显著增强了抑制蛋白表达的生物功能(ACS Nano,2014,8,6288–6296)。

为了促进纳米粒与光协同增强的胞内递送技术向临床应用快速转化,应避免纳米粒与细胞直接接触导致纳米粒“侵入”细胞。针对该难题,他们提出了聚合物薄膜“锚定”纳米粒的设计策略,即通过旋涂成型工艺将纳米粒嵌入聚合物薄膜内,再与光协同引发纳米微泡效应,促进黏附或生长在薄膜上的细胞产生局部精准破膜,增强细胞渗透性,实现纳米粒“非侵入”细胞的安全胞内递送(Adv. Mater., 2021, 33, 2008379)。然而,基于旋涂工艺制备的“实体”聚合物薄膜的膜内孔隙率低、孔径小,可能会限制功能生物大分子的胞内递送效率。基于他们近年来在静电纺丝领域积累的研究成果,进一步提出了静电纺丝纳米纤维“锚定”纳米粒的新策略,创建了复合纳米纤维膜与光协同增强且纳米粒“非侵入”细胞的胞内递送新方法,不仅显著地将免疫T细胞的siRNA胞内递送效率从10%提高至40%,而且同时保证了免疫细胞的生物功能特性完好无损,为难以兼顾处理通量、效率、安全的胞内递送难题提供了有效解决方法(如图1,Nat. Nanotechnol., 2021, 16, 1281)。具体地,利用静电纺丝技术制备了内嵌四氧化三铁光敏纳米粒的聚己内酯(PCL)复合纳米纤维膜。在生物大分子递送过程中,分散在溶液中的大分子可在高孔隙率、大孔径的纳米纤维薄膜中迅速扩散,极大提高了大分子在细胞膜局部破膜处的浓度,从而提高了递送效率。同时,质谱检测发现处理后的细胞体内铁元素含量与对照组无显著差别,证明了该过程是纳米粒“非侵入”细胞内的安全递送。通过递送siRNA功能化的免疫T细胞,在免疫缺陷小鼠体内表现出显著的肿瘤抑制效果。
为了提高大粒径生物大分子如信使核糖核酸(mRNA)、质粒脱氧核糖核酸(pDNA)的胞内递送效率,他们进一步提出了复合纳米粒与光协同生成纳米微泡“推动”生物大分子进入细胞内的递送新思路,与传统依靠分子“被动扩散”进入细胞的递送方法相比,发现mRNA、pDNA胞内递送效率分别显著提高了约6倍和8倍(如图2)。
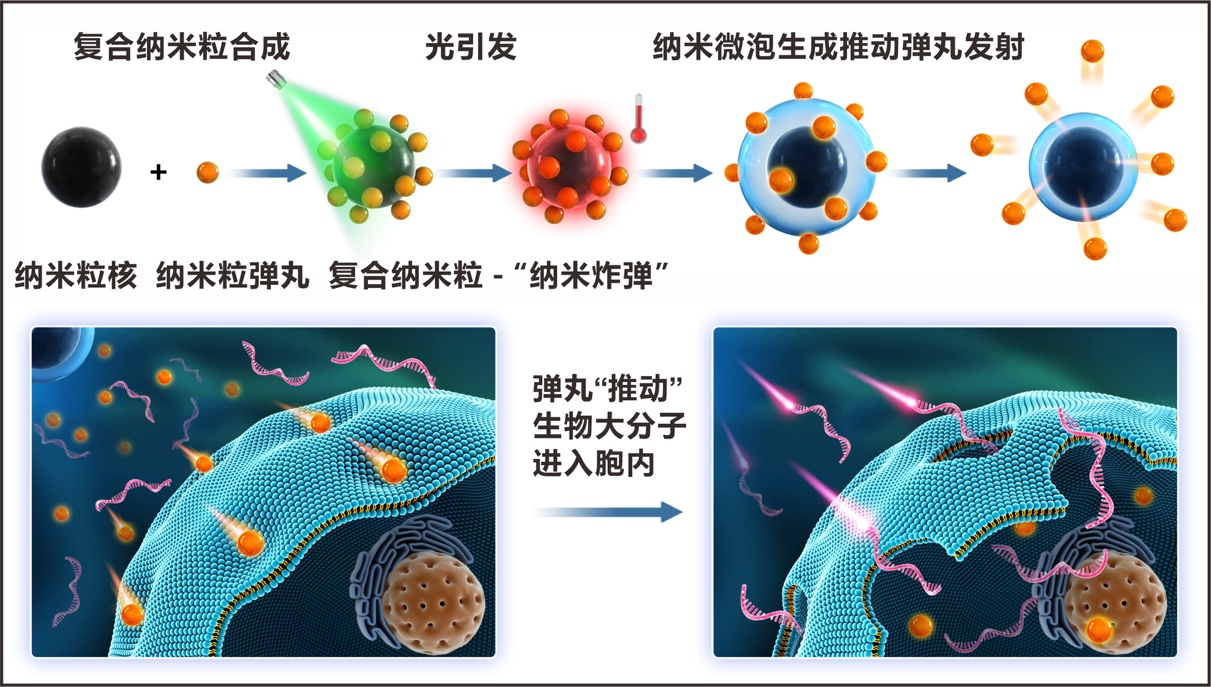
图2 复合纳米粒与光协同生成纳米微泡“推动”生物大分子进入胞内的递送示意图
具体地,通过在纳米粒表面荷载纳米弹丸,合成了一种新型复合纳米粒结构的“纳米炸弹”;在光协同作用下,纳米粒快速吸收光能转化成热能,诱导生成纳米微泡,形成“爆炸”推力,推动其表面荷载的纳米“弹丸”局部穿破细胞膜,但该局部破膜作用尚不会对细胞的主体结构产生整体影响,从而安全地“推动”分散在溶液中的生物大分子进入到细胞内,实现高通量、高效的生物大分子胞内递送。

图3 由四氧化三铁核纳粒和200 nm聚苯乙烯纳米球组成的200-“纳米炸弹”的合成、表征和激光引发。
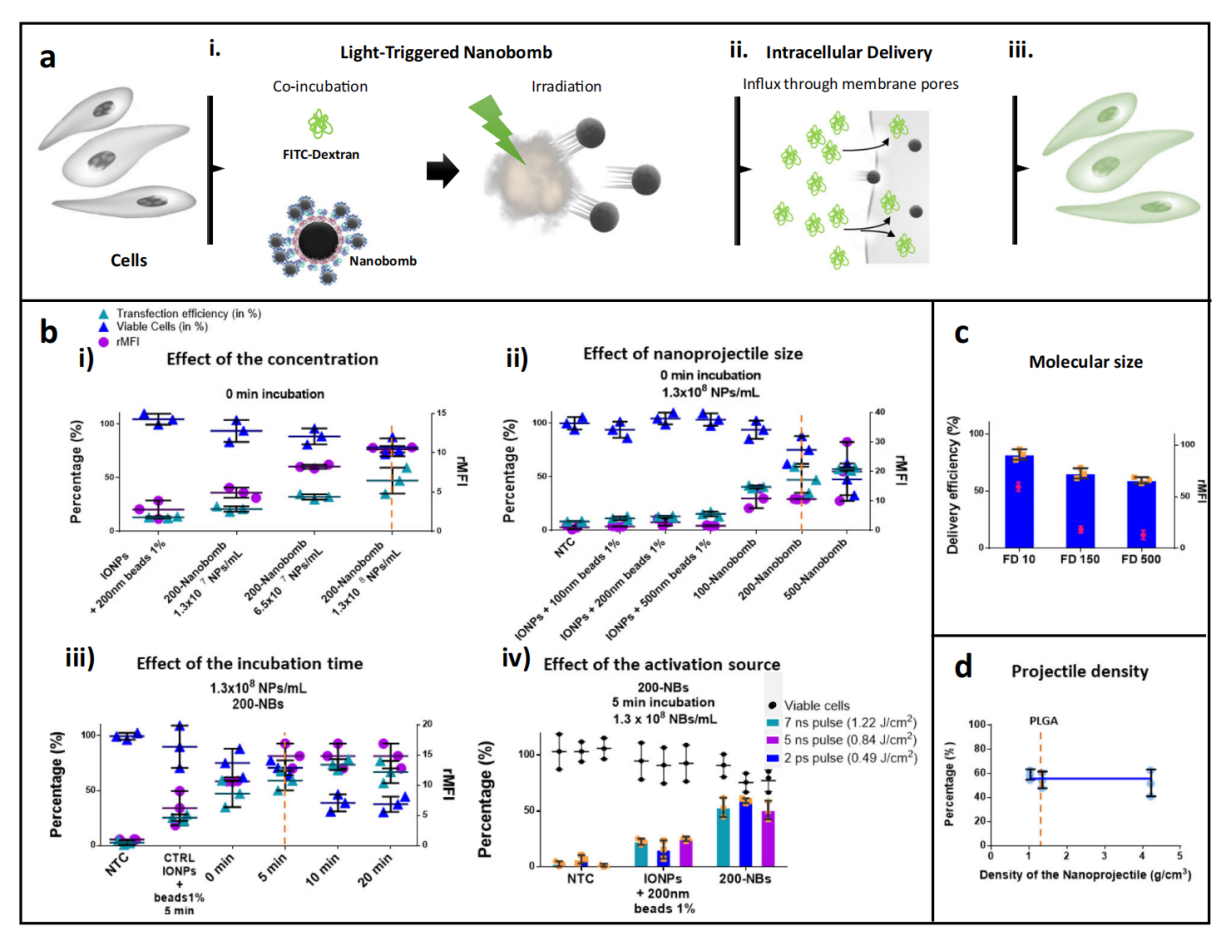
图4 200-“纳米炸弹”激光引发及其与细胞相互作用的实验和理论研究。

图5 应用200-“纳米炸弹”向贴壁细胞HeLa和悬浮细胞Jurkatm胞内递送功能生物大分子RNA和pDNA。
全文链接: https://doi.org/10.1038/s41467-022-29713-7
实验室主页:https://www.x-mol.com/groups/nfu-ugent
- 武汉大学陈朝吉/余乐 Natl. Sci. Rev.:可回收电凝胶化生物大分子水凝胶电解质助力可持续宽温域锌金属电池 2025-08-11
- 苏州大学李刚教授、美国国家标准与技术研究院Wai Cheong Tam博士 IJBM:牙周组织生物大分子研究进展 2025-05-22
- 苏大李刚、余嘉/港理大赵泽宇 Int. J. Biol. Macromol.:伤口修复生物大分子材料的研究进展 2024-04-03
- 南京林业大学黄超伯/熊燃华课题组 Nat. Protoc.:光热电纺纳米纤维的胞内递送及其在细胞免疫治疗的应用 2025-01-23
- 华南理工大学王辉团队 Nano Lett.:淀粉样变新材料多方面治疗阿尔兹海默症 2024-10-09
- 东华大学沈明武/史向阳教授团队 ACS Nano:生物活性的含磷树状大分子作为通用型蛋白质递送系统用于增强的抗炎治疗 2024-01-12
- 中国矿大(北京)王萌/北大杨槐 AFM:提出一种“化学门控氢键”策略 - 实现蓝相液晶聚合物薄膜在湿度响应中的多功能集成 2025-11-12
