蛋白类药物因其高特异性和低副作用而越来越被认为是药物开发和疾病治疗领域中有希望的候选者。然而,大多数蛋白质由于分子量大、膜渗透性差、易被酶降解等特点而难以穿过细胞膜并作用于细胞内疾病靶点。因此,开发针对细胞内疾病靶点的简单高效的蛋白质递送技术是扩大蛋白质药物应用场景的重要途径。
一般来说,细胞内蛋白质递送的策略包括物理方法(如电穿孔、纳米针、微流控和T细胞介导的孔形成)或化学方法(如蛋白质与细胞穿透肽、转导结构域、两亲性小分子等渗透性模块的共价结合)。尽管这些细胞内递送蛋白质的方法有效,但也存在不可忽视的缺点,包括依赖于苛刻的设备条件、蛋白质化学修饰需要花费额外的时间和费用、细胞活力受损、蛋白质活性降低、内涵体逃逸效率差等。在这种情况下,基于非共价相互作用的纳米载体,如脂质体、纳米凝胶、外泌体和聚合物为有效的细胞内蛋白质递送提供了更多的选项。
在众多的纳米载体体系中,表面修饰磷酯酸钠盐的阴离子型含磷树状/树冠大分子具有特定的生物活性,如抗炎、免疫调节、促进NK细胞增殖等特性。因此,各种基于含磷树状/树冠大分子的纳米平台已被构建用于化疗药物的胞内递送。其中,阳离子型含磷树状大分子、PAMAM、PEI等高分子载体与蛋白质的相互作用已被报道并被应用到蛋白质的胞内递送中。然而,考虑到高密度的正电荷可能会导致不可预测的细胞毒性,因此,依赖负电荷递送蛋白质到细胞内的必要性需要重新评估。此外,大量载体的不合理使用所导致的代谢和清除不良,也可能引发机体毒性。因此,开发基于具有固有免疫调节活性的阴离子型含磷树状大分子的蛋白质胞内递送载体有望解决以上问题,并可通过载体和蛋白质的功能协同发挥增强的治疗效果。
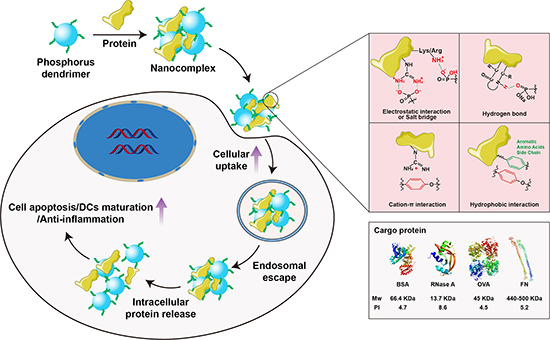
图1. 含磷树状大分子AK-137通过各种物理相互作用与蛋白质络合用于细胞内蛋白质的递送。
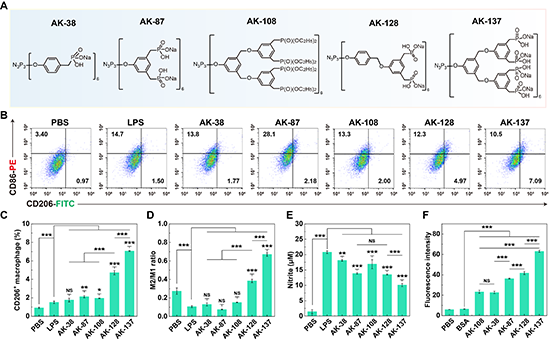
图2.(A)不同含磷树状大分子的结构图;(B-D)流式细胞术分析不同含磷树状大分子处理RAW264.7细胞后细胞表面CD86和CD206的表达变化;(E)含磷树状大分子抑制RAW264.7细胞释放亚硝酸盐的能力;(F)不同含磷树状大分子胞内递送BSA的效率。

图3.(A-B)AK-137与BSA在不同质量比下的水合粒径和表面电势;(C)Cy5.5-BSA的荧光发射光谱;(D)AK-137@BSA NCs的TEM图像;(E-F)AK-137和AK-137@BSA NCs的AFM图和相应高度图;(G)AK-137@BSA NCs一周内的水合粒径变化;(H-I)AK-137@BSA NCs细胞内摄取的流式图和CLSM图像;(J-K)不同内吞抑制处理的细胞对AK-137@BSA NCs摄取水平的变化。

研究团队进一步探究了FN的胞内递送产生的生物学效应。巨噬细胞极化实验显示AK-137和FN均能在一定程度上诱导巨噬细胞群体从M1表型向M2表型极化,但是效果是有限的。AK-137@FN NCs在AK-137和FN的协同以及增强的FN胞内递送效果的共同作用下表现出最低的CD86水平和最高的CD206水平(图5A-C)。同时,AK-137@FN NCs也可以有效促进巨噬细胞中Arg-1水平的升高,抑制iNOS的表达(图5D),有效促进巨噬细胞向抗炎M2表型的极化。另外,AK-137通过促进FN的细胞内递送进一步放大了FN的抗氧化能力,有效降低细胞内ROS水平(图5E-F)。得益于AK-137@FN NCs优异的免疫调节活性和抗氧化性能,LPS激活的巨噬细胞内的促炎性细胞因子(TNF-α、IL-1β、IL-6)的表达水平也被有效降低,并且这种抗炎性能可能是通过抑制PI3K/Akt和NF-κB信号通路实现的(图5G-J)。
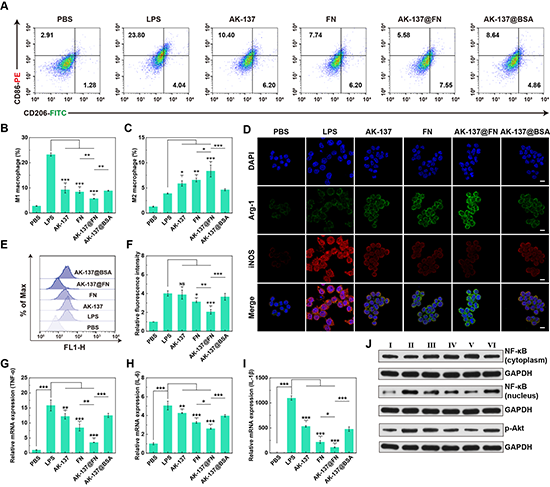
图5.(A-C)不同材料处理后MH-S细胞表面CD86和CD206表达水平的流式检测结果;(D)不同材料处理后MH-S细胞中Arg-1和iNOS的表达水平;(E-F)不同材料处理后MH-S细胞中ROS水平变化;(G-I)qPCR分析不同材料处理后细胞内促炎性细胞因子的相对mRNA表达水平;(J)Western blot分析不同材料处理后MH-S细胞中p-Akt和NF-κB的表达水平。
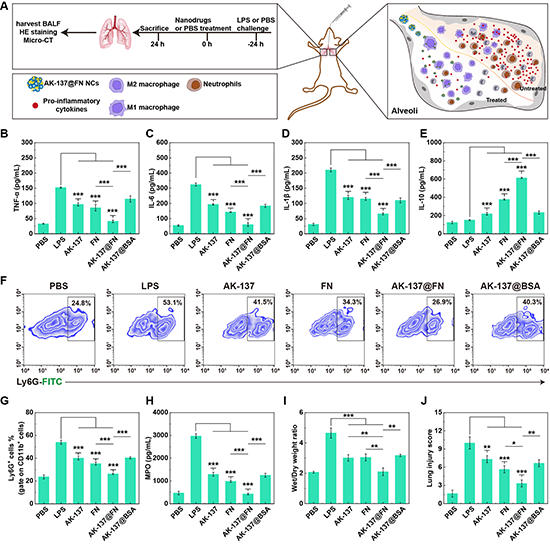
图6.(A)ALI小鼠体内抗炎治疗示意图。(B-E)不同材料治疗后ALI小鼠BALF中促炎因子(TNF-α、IL-6、IL-1β)和抗炎因子IL-10的表达水平。(F-H)不同组ALI小鼠治疗24 h后肺组织中性粒细胞百分比和BALF中中性粒细胞生物标志物MPO的表达水平。(I-J)不同处理组ALI小鼠肺干湿重比和肺损伤评分。

图7.(A)AGA体内抗炎治疗示意图。(B-C)不同材料处理后AGA小鼠踝关节肿胀程度和踝关节代表性热像图。(D)不同材料处理后AGA小鼠踝关节的H&E染色。(E-F)不同材料处理后AGA小鼠踝关节组织TNF-α和IL-1β的免疫荧光染色。
简而言之,该研究设计的基于含磷树状大分子的蛋白质递送平台具有多个优势:1)合成了具有固有免疫调节活性、稳定的含磷树状大分子;2)提供了一种“简单、有效和非侵入性”的蛋白质递送策略,不需要对载体和蛋白质进行额外的功能修饰;3)含磷树状大分子AK-137通过促进功能蛋白的细胞内递送改善了其生物利用度,可在不同的靶细胞内发挥各自的功能,包括癌细胞凋亡、树突细胞成熟或巨噬细胞免疫调节等;4)构建的AK-137@FN复合物通过增强FN的胞内递送并协同AK-137载体自身抗炎性能,在急性肺损伤和急性痛风性关节炎模型中展现出良好的治疗效果。该研究为非阳离子型聚合物基的细胞质蛋白质递送载体的合理设计提供了重要的思路,因而可能扩展蛋白质药物的广泛生物医学应用。
文章链接:https://doi.org/10.1021/acsnano.3c09589
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学沈明武/史向阳团队《Acta Biomater.》:含磷树状大分子介导的生物矿化用于协同的肿瘤阻断治疗与乏氧激活化疗 2025-04-28
- 东华大学史向阳教授团队 Nano Today:基于含磷树状大分子的药物递送系统协同增强自噬、抗炎和抗氧化治疗阿尔茨海默症 2025-02-11
- 浙江大学毛峥伟教授课题组Adv. Mater.:一种通用的聚电解质-锁定策略:从普通蛋白质到稳定的展开蛋白基粘合剂以实现快速稳健的组织密封 2025-12-25
- UCLA贺曦敏/燕山大学秦志辉、焦体峰 Adv. Mater.: 具有优异机械性能和耐久性的完全可降解蛋白质凝胶-氢键供体的调控 2025-06-27
- 华东理工刘润辉教授课题组 CCS Chem.:有效稳定蛋白质的伴侣样活性丝胶蛋白 2025-06-17
- 南京林业大学黄超伯/熊燃华课题组 Nat. Protoc.:光热电纺纳米纤维的胞内递送及其在细胞免疫治疗的应用 2025-01-23
