多重耐药(MDR)细菌即所谓“超级细菌”(Superbug)的出现,使人类面临对MDR细菌感染无药可治的窘境。同时,由于细菌可以侵入动物细胞并且在其中存活,被感染细胞的细菌成了“特洛伊木马”,不仅保护细菌逃逸免疫清除和抗菌药物杀伤,有助于细菌从最初感染部位向其他健康组织扩散。传统抗菌药物很难对此类胞内菌实现有效杀伤,导致临床上病原菌呈现持续感染、反复发作等特征。为了更好地治疗胞内MDR细菌感染,迫切需要开发新型抗菌药物和治疗策略。前期研究发现聚集诱导发光材料(AIEgens)在具有很好的抗菌活性,但其作用机制尚不清楚,且缺乏治疗胞内感染研究。
近日,香港科技大学、深圳大学唐本忠院士团队与中国农业大学沈建忠院士团队朱奎教授合作以“Efficient Killing of Multidrug-Resistant Internalized Bacteria by AIEgens in Vivo”为题在Advanced Science发表最新研究进展,揭示AIEgens单独抗菌作用及其增强宿主细胞抗菌的分子机制。在前期工作的基础上(Small Methods, 2020,2000046),选取作用于革兰阳性菌效果较好的TBPs(TBP-1和TBP-2)作为研究对象,发现TBPs靶向识别金黄色葡萄球菌细菌内膜的磷脂酰甘油(PG)和心磷脂(CL)(图1)。此外,在30天耐药性连续诱导试验中发现TBPs没有产生耐药性,远优于阳性对照药物Oxacillin。这些结果表明TBPs作用靶点明确且不易产生耐药性是较理想的抗菌先导化合物。

图1. TBPs靶向识别细菌内膜的磷脂分子
为进一步探究TBPs对胞内细菌的杀伤能力,作者首先进行胞内杀菌实验,发现TBPs呈现浓度依赖性地杀死胞内菌。随后以TBP-1为例进行胞内抗菌机制研究,发现TBPs能够促进线粒体ROS的释放,升高细胞内ROS水平,促进细胞自噬,清除胞内细菌(图2)。此外,TBP-1能够在溶酶体内累积,提高溶酶体内细菌的清除效率。小鼠腹膜炎感染模型表明TBPs能够显著地降低小鼠死亡率和脏器内的细菌载量。整体来说,TBPs对小鼠的腹膜炎模型具有很好的治疗效果,为治疗细胞内细菌的新型抗菌药物研发提供新思路。
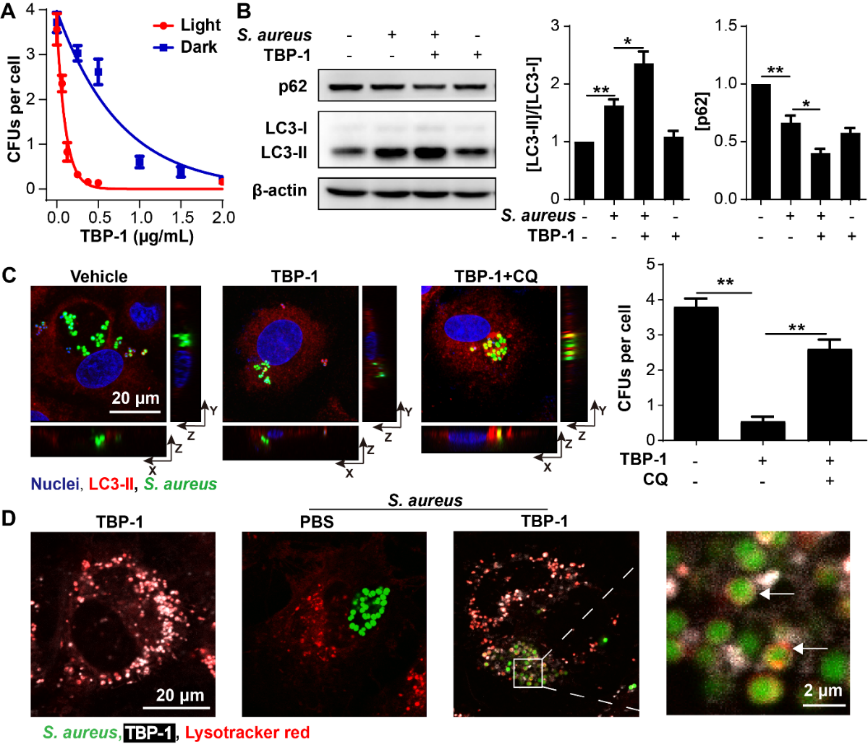
图2. TBP-1增强自噬促进细胞内金黄色葡萄球菌的清除
综上所述,作者发现TBPs不仅对能够靶向胞外细菌膜上的PG和CL,促进细菌ROS产生破坏细菌的膜结构来达到杀菌目的,还可以通过促进细胞自噬促进细胞内细菌的清除(图3)。该研究揭示AIEgens抗菌作用的分子机制,丰富了宿主导向抗菌药物开发的药源分子,为新型AIEgens的分子设计提供新思路。

图3. TBPs抗菌示意图
论文的第一作者为深圳大学李莹副研究员与中国农业大学博士生刘飞(共同第一作者),通讯作者为唐本忠院士与中国农业大学朱奎教授。本研究获得了国家重点研发计划(2017YFC1600305)、国家自然科学基金(31772796, 22005195)等项目资助。
论文链接:http://doi.org/10.1002/advs.202001750
- 南林蔡旭敏、港中深唐本忠/汪文锦团队 AFM: 松香基天然电子受体构建TICT活性的双功能BioAIE材料 2025-07-22
- 唐本忠教授/林荣业教授团队、胡连瑞研究员 Nat. Commun.:变色龙聚集诱导发光分子在光、热调控下六重稳定态的可控转换 2025-07-11
- 香港中文大学(深圳)唐本忠院士/赵征教授团队《ACS Nano》:细胞膜靶向的聚集诱导发光分子用于神经追踪和损伤的可视化 2025-01-21
- 港中大(深圳)唐本忠教授、赵征教授/港科大林荣业教授团队 Matter: 基于立体异构AIEgens在动态信息防伪与加密的应用 2025-07-28
- 中山大学顾林课题组 CEJ:在无需外加AIEgens的情况下,利用商业化聚酰胺固化剂的簇发光性质实现环氧涂层自主损伤检测 2024-09-26
- 港科大唐本忠/浙大张浩可 Nat. Commun.:含杂环AIEgens邻近效应的调控 2023-07-21
- 东华大学朱美芳教授、贾超副研究员等 AFM:抗菌、制冷多功能聚乙烯纤维防护材料 2026-01-06
