乳腺癌小鼠被近红外激光照射3分钟后,早已等候在肿瘤部位的“药匣子”打开了:抗肿瘤药物快速均匀地渗透到肿瘤深层组织。4小时后,肿瘤细胞陆续凋亡……
在浙江大学转化医学院完成的这一实验,显示出一种新型纳米载药系统的巨大威力。抗癌药搭乘这种纳米“载具”,就像钢铁侠穿上了那套神奇的装甲,不仅能在体内待得更久,还能更有效地穿透层层障碍,直达肿瘤深层组织。
浙大医学院附属第二医院和转化医学研究院周民研究员团队取得的这一创新成果日前已发表在著名期刊《先进功能材料》(Advanced Functional Materials),并被编辑部遴选为纸质版封面文章。论文审稿人认为:“这个设计非常吸引人,可能更具有较高的治疗价值和转化前景。”

在实验室中表现优异的抗癌药物,用到临床上效果打折扣,一个关键的难题在于:药物“跑太快”,“跑不远”。 “跑太快”指的是药物的代谢速度快,一般情况下,不到24小时药物就会就被代谢出体外,药效发挥的时间很短,真正能到达肿瘤的药物很少。“跑不远”,是因为肿瘤细胞深层没有血管分布,而传统的抗癌药物分子要通过血管才能到达肿瘤细胞,血管到达不了的地方,也是药物到达不了的地方。
周民团队最新设计的多级载药系统,就是针对临床上这种现实需求研发的。“药物+载体”是一种常见的药物设计方案,科研人员改造了一种广谱型抗癌药——阿霉素,让多个阿霉素小分子搭乘纳米颗粒载体,形成一个聚合球。“通过组装,我们能对这个聚合球进行表面修饰操作,从而调节它在机体内的行为。”论文第一作者、实验技术员马飞说,通过这个设计,药物的个头变大了,一定程度延长了药物在机体内停留的时间。
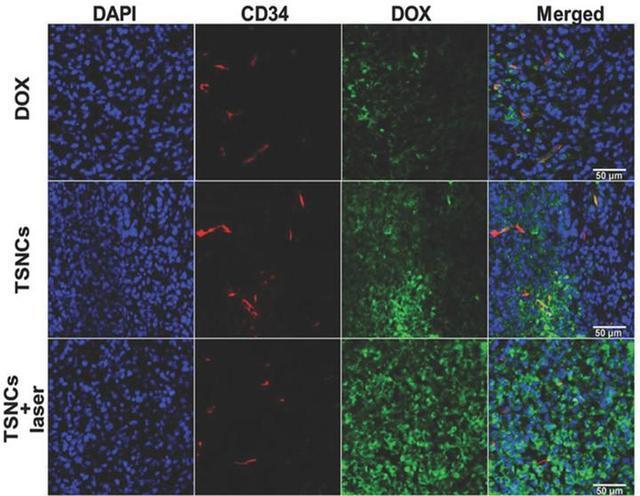
肿瘤组织的免疫荧光染色结果表明,纳米聚合球中的阿霉素(绿色荧光)不但可以在肿瘤内血管(红色荧光)周围有分布,而且在近红外激光激发下,可以在肿瘤深层组织具有非常好的分散性,表明阿霉素可以高效的“跑到“深层肿瘤组织
个头变大还不够,周民团队设计的抗癌药物聚合球还是一种光控的“药匣子”,这个具有光活性的纳米团簇,只有在特定波长的光的激发下,抗癌分子才会释放扩散。
直径约40纳米的纳米团簇通过静脉注射到乳腺癌小鼠体内,药物团簇通过血液系统向肿瘤蓄积,24小时后,它们只等体外一束激光的命令。课题组选用的是800纳米波长的近红外光,这种光线的穿透力很强,最多能穿透5厘米左右的生物组织。在光的命令下,纳米球解体为超小尺寸的纳米点和抗癌分子,在肿瘤组织内部快速渗透。“超小尺寸的纳米点和药物具有较高的渗透能力,因此药物能够顺利渗透到肿瘤深层组织。”马飞说。
进一步实验表明,这种多级载药系统不但可以高效地摧毁肿瘤细胞,同时还可以显著抑制肿瘤干细胞的生长。可以在消除原位肿瘤的同时,抑制肿瘤转移的发生。由于具有较好的肿瘤集聚能力,该系统可以显著降低抗肿瘤药物的心脏和系统毒性,具有较高的临床转化前景。
需要指出的是,尽管该方法的治疗效果让人鼓舞,但是目前实验结果仍仅仅在小动物水平得到了验证。“想要应用于临床,仍需要大量的试验。不过可以肯定的是,我们找到了能够提升肿瘤治疗效率和治疗安全性的新方法,这是一个正确的研究方向。”周民认为,该项研究工作的研发为未来的精准医疗和个性化药物发展提供了新的思路,为肿瘤的精准治疗提供了一种新的策略。
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 苏州大学冯良珠教授、刘庄教授团队 AFM:温敏催化水凝胶助力酶触“破膜+氧化应激”级联肿瘤消融新策略 2025-12-04
- 四川大学何斌/蒲雨吉 ACS Nano:高分子化丁酸纳米平台治疗肠炎 2023-12-24
- 华南理工朱伟 Adv. Sci.:基于红细胞和MOF-级联酶的人工生物杂化体用于高尿酸血症治疗 2023-12-17
- 长期有效 | 西南交大周绍兵教授团队诚招博士、推免硕士 - 材料、生物医学工程 2023-09-23
