近年来,癌症疫苗作为免疫治疗的一种形式,相比手术、放疗和化疗等传统治疗方式具有独特优势。它通过诱导肿瘤特异性免疫反应产生长期记忆效应,可防止肿瘤复发、减轻患者痛苦、提高生存率。然而,众多正在开展的癌症疫苗临床研究仍不尽如人意,主要受制于抗原交叉呈递效率低下、肿瘤微环境(TME)免疫抑制等挑战。纳米疫苗已成为解决这一问题的有效途径。
开发有效的纳米疫苗,关键在于在特定纳米载体中结合抗原与佐剂。肿瘤源性外泌体(Exos)作为内源性囊泡,不仅天然携带多种肿瘤相关抗原(TAAs),还具有良好的生物相容性。已有研究表明一些癌细胞分泌的Exos可作为构建广谱肿瘤疫苗的理想抗原。此外,Exos具备同源肿瘤靶向特异性,能直接与肿瘤细胞膜融合,在先进给药系统开发中应用前景广阔。因此基于Exos的疫苗设计在癌症免疫治疗中极具潜力。
在免疫治疗中有效激活T细胞,需通过将抗原/佐剂直接递送至树突细胞(DCs),或借助癌细胞的免疫原性细胞死亡(ICD)促进DCs成熟。肿瘤相关巨噬细胞(TAMs)是TME中最丰富的免疫细胞,多表现为M2表型,在免疫抑制和肿瘤进展中发挥促进作用;且TAMs溶酶体的酸性环境常导致疫苗递送的TAAs过度降解,阻碍其有效激活DCs等抗原呈递细胞以启动抗肿瘤免疫应答。因此,通过复极化调节TAMs为抗肿瘤M1表型,或诱导TAMs溶酶体功能障碍,进而增强与癌细胞或DCs的相互作用、提升抗肿瘤免疫应答,具有重要意义。但目前鲜有研究关注癌症纳米疫苗的双重或多重靶点,这类靶点需同时解决抗原交叉呈递低效、TME免疫抑制及无法同步重编程多种细胞类型的问题。
近年来,树状大分子纳米凝胶(DNGs)受到广泛关注,它结合了树状大分子与纳米凝胶的特点和优势,具有良好的水分散性、流动性,易于表面修饰,可掺入造影剂(如Au NPs)和药物,能提高癌细胞吞噬能力、增强肿瘤细胞渗透性和滞留效应。此外,通过设计不同交联剂可制备响应TME的DNGs,实现药物按需释放。这些特性使DNGs成为开发多功能纳米疫苗的理想平台,既能解决抗原交叉呈递低效、TME免疫抑制及无法同步重编程多种细胞类型的挑战,还可通过结合造影剂实现肿瘤成像。
本研究开发了一种外泌体伪装的DNGs纳米疫苗:以丰加霉素(Toy)偶联的第3代聚酰胺-胺树状大分子为单体,FBA-PEG-FBA为交联剂,通过反相微乳液技术制备DNGs,原位负载金纳米粒子(Au NPs),物理负载免疫佐剂CpG,最后包被癌细胞来源的Exos,得到Au-DNGs/CpG@Exo(图1A)。该纳米疫苗在模拟TME环境中可快速释放Toy,实现Exos介导的肿瘤靶向、Toy化疗介导的ICD以及ICD、CpG和Exo协同促进的三重DCs成熟;同时通过Au NPs介导的TAM M1复极化和溶酶体功能障碍诱导增强免疫调节作用,整合多种免疫调节机制有助于重塑免疫抑制微环境,达成最佳抗肿瘤效果(图1B)。
2026年2月15日,相关研究成果以“Biomimetic Exosome-Camouflaged pH-Responsive Dendrimer Nanogels as a Therapeutic Vaccine against Pancreatic Cancer through Reprogramming of Multiple Cell Types”为题,在线发表于国际著名期刊Advanced Functional Materials (DOI: 10.1002/adfm.202420825)。东华大学生物与医学工程学院沈明武研究员/史向阳教授为共同通讯作者,博士研究生李燕莹为第一作者。该工作得到了国家自然科学基金委和上海市科学技术委员会等项目的资助。
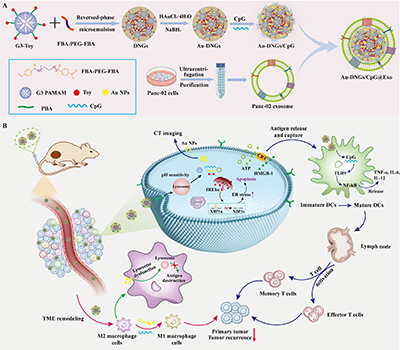
图1.仿生Exo-DNG疫苗(Au-DNGs/CpG@Exo)的制备(A)及抗肿瘤机制(B)。
透射电镜(TEM)与原子力显微镜(AFM)结果表明DNGs呈均匀球形(图 2A-C)。TEM与SEM图像显示负载纳米金的Au-DNGs也为均匀分散的球形结构(图2D-E)。Exo呈现典型杯状或碟状形态,纳米颗粒跟踪分析(NTA)测得其粒径主要分布于100–200 nm之间(图2F)。WB分析(图2H)与激光共聚焦显微镜(CLSM)图像(图2G)显示,Au-DNGs/CpG@Exo高表达外泌体标志性蛋白TSG101与CD81,且红绿荧光共定位,证实Exo成功包覆于Au-DNGs/CpG表面。不同pH条件下水合粒径变化及药物释放结果表明Au-DNGs/CpG@Exo具有pH响应性(图2I-J)。Au-DNGs/CpG@Exo的CT成像强度与CT值随Au浓度升高而增加,显示其在肿瘤CT成像中具备良好潜力(图2K)。
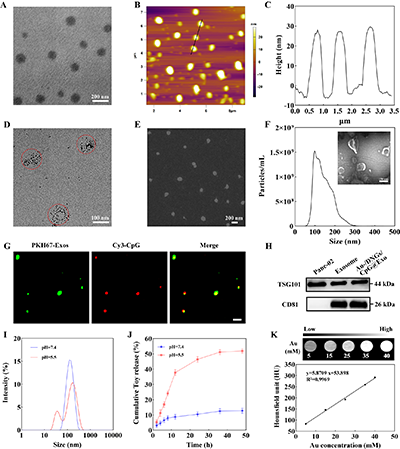
图2. DNGs的TEM图像(A)、AFM图像(B)和相应的AFM高度(C)。Au-DNGs的TEM图像(D)和SEM图像(E)。(F)Panc-02细胞源性Exos的NTA结果和TEM图像。(G)Cy3-CpG@PKH67-Exo的CLSM图像。(H)Panc-02细胞、Exos和Au-DNGs/CpG@Exo中TSG101和CD81蛋白的表达情况。(I)不同pH值下Au-DNGs/CpG@Exo的水动力粒径分布图和(J)Toy释放曲线。(K)不同Au浓度下Au-DNGs/CpG@Exo的体外CT成像和HU值随Au浓度的线性拟合。
通过体外癌细胞实验验证发现,在相同Toy浓度下,Au-DNGs/CpG@Exo在所有材料中抗癌活性最强(图3A)。PKH67绿色荧光与Cy3红色荧光共定位呈明显橙色,表明Au-DNGs/CpG@Exo在细胞摄取3小时后仍保持结构完整(图3B)。Au-DNGs/CpG@Exo的摄取主要通过脂质筏/囊泡依赖及网格蛋白介导的内吞作用实现(图3C-D)。CLSM与流式细胞术分析显示,Au-DNGs/CpG@Exo可显著提升Panc-02细胞吞噬效率,表明Exo赋予其同源癌细胞靶向特异性(图3E-I)。
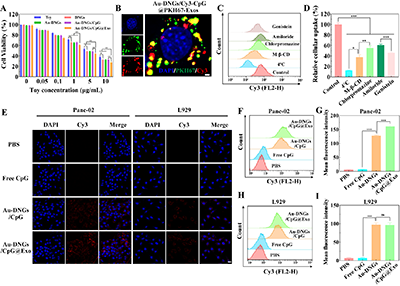
图3.(A)不同配方处理24小时后Panc-02细胞活力测定。(B)Au-DNGs/CpG@Exo处理3小时后Panc-02细胞CLSM图像。Panc-02细胞用不同的内吞抑制剂预处理2小时后与Au-DNGs/CpG@Exo孵育4小时后的流式细胞术分析(C)和荧光定量(D)。(E)Panc-02细胞与L929细胞分别用PBS、游离CpG、Au-DNGs/CpG和Au-DNGs/CpG@Exo处理4小时的CLSM图像以及Panc-02(F-G)和L929细胞(H-I)经不同材料孵育4小时后的流式细胞术分析和细胞吞噬定量。
进一步的体外实验发现,Au-DNGs/CpG@Exo可使巨噬细胞溶酶体碱化(绿色荧光强度降低),引发溶酶体功能障碍(图4A-C)。流式细胞术(图4D)及M1/M2定量分析(图4E)表明,Au-DNGs/CpG@Exo可促使M2型TAMs复极化为M1型,且CpG递送可与Au NPs协同增强该极化作用。Au-DNGs/CpG@Exo可直接促进DCs成熟,并上调其表面MHC-I与MHC-II分子表达(图4F-J)。
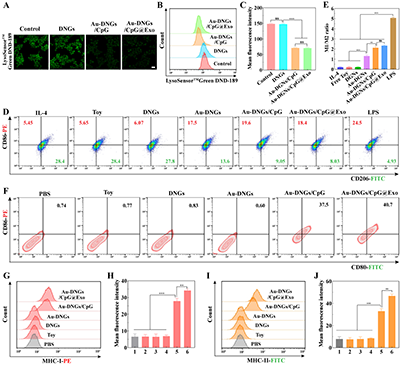
图4. 不同材料处理48小时后,经LysoSensor Green DND-189染色的RAW264.7细胞的CLSM图像(A)、流式细胞术分析(B)和平均荧光定量(C)。IL-4诱导的RAW264.7细胞经不同制剂处理24小时后的流式细胞术分析(D)及巨噬细胞M1/M2比值定量(E)。经不同制剂处理24小时的DCs细胞流式细胞术分析(F)和成熟水平(G)。不同材料处理DCs 24小时后MHC-I(H)和MHC-II(I-J)表达的流式细胞术分析和荧光定量分析。
团队下一步构建Panc-02小鼠皮下瘤模型,考察Au-DNGs/CpG@Exo的体内抑瘤效果与免疫激活能力。治疗期间,各治疗组小鼠体重无明显变化,表明所有材料的毒性都可以忽略不计(图5B)。与其他组相比,Au-DNGs/CpG@Exo组肿瘤体积与重量均最小(图5C-E)。肿瘤组织切片染色显示,Au-DNGs/CpG@Exo组出现大面积坏死、大量细胞凋亡及微弱细胞增殖(图5F-H)。免疫荧光染色结果显示,Au-DNGs/CpG@Exo组肿瘤组织CRT暴露与iNOS水平显著升高,Arg-1水平明显降低(图5I-K),证实其可有效抑制胰腺癌生长并产生ICD。

图5. (A)肿瘤模型建立及纳米疫苗治疗效果分析示意图。荷瘤小鼠在治疗期间的体重变化(B)和肿瘤体积变化曲线(C)。治疗后14天各组肿瘤重量(D)和小鼠肿瘤图像(E)。经不同材料处理14天后肿瘤切片的(F)H&E、(G)TUNEL、(H)Ki67、(I)CRT、(J)iNOS和(K)Arg-1染色。
进一步采用流式细胞术探究Au-DNGs/CpG@Exo的体内免疫激活效应。Au-DNGs/CpG@Exo可显著提升脾脏中CD4+T细胞、CD8+T细胞、中央记忆T细胞(TCM)及效应记忆T细胞(TEM)比例(图6A-B)。该复合物可显著提高肿瘤组织中CD8+T细胞、CD4+T细胞比例,同时降低调节性T细胞(Tregs)比例(图6C-E)。免疫荧光染色结果显示,与PBS组相比,各处理组肿瘤组织中CD4+和CD8+T细胞浸润均增加,其中Au-DNGs/CpG@Exo组荧光信号最强(图6F-G),与流式结果一致。上述结果表明,Au-DNGs/CpG@Exo可有效增强机体抗肿瘤免疫应答。

图6. 经不同处理后的小鼠脾脏CD4+和CD8+ T细胞(A)、CD8+CD44+CD62L+ TCM细胞和CD8+CD44+CD62L- TEM细胞(B)的代表性流式细胞术图。不同处理后小鼠肿瘤中CD3+CD8+ T细胞(C)、CD3+CD4+ T细胞(D)和CD4+Foxp3+CD25+ Tregs(E)的代表性流式细胞术图。不同处理后肿瘤组织中CD4+ T细胞(F)和CD8+ T细胞(G)浸润的代表性免疫荧光图像。
团队随后分析Au-DNGs/CpG@Exo对胰腺癌的预防效果。4次疫苗免疫后,小鼠脾脏中CD4+T细胞、CD8+T细胞、TCM及TEM比例显著升高(图7B-C)。免疫后小鼠接种肿瘤,Au-DNGs/CpG@Exo组肿瘤体积与重量最小、小鼠生存期最长。接种肿瘤20天后,该组肿瘤组织中CD4+T细胞、CD8+T细胞比例显著升高,Tregs比例明显降低(图7H-J)。上述结果表明,Au-DNGs/CpG@Exo可有效诱导长期免疫记忆效应,并抑制胰腺癌复发。
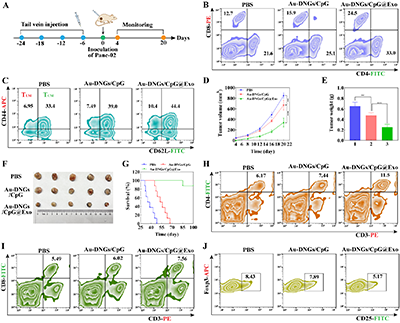
图7. 纳米疫苗预防胰腺癌的效果分析。(A)小鼠疫苗免疫后接种癌细胞预防肿瘤复发的过程示意图。不同组小鼠接种4次疫苗后脾脏中CD8+和CD4+ T细胞(B)、CD8+CD44+CD62L+ TCM细胞和CD8+CD44+CD62L- TEM细胞(C)的代表性流式细胞术分析。不同疫苗接种小鼠的肿瘤生长曲线(D)和肿瘤重量(E)。(F)不同治疗后的肿瘤照片。(G)4次疫苗免疫后小鼠的存活率。小鼠接种皮下肿瘤20天后肿瘤中CD3+CD4+ T细胞(H)、CD3+CD8+ T细胞(I)和CD4+Foxp3+CD25+ Tregs(J)的代表性流式细胞术图。
总的来说,该研究设计的Exo仿生DNGs纳米疫苗具有多个优势:(1)DNGs的pH响应性可实现药物在酸性肿瘤微环境中的精准释放;(2)肿瘤源性Exos赋予纳米疫苗大量抗原和同源肿瘤靶向功能;(3)化疗诱导的ICD,结合纳米疫苗成分CpG和Exos携带的TAA可增强免疫激活;(4)Au NPs通过诱导TAMs中溶酶体功能障碍和重塑免疫抑制微环境来提高抗原递呈效率,并因其优异的X-射线衰减性能而使CT成像引导治疗成为可能。该Exo基DNG纳米疫苗可重编程肿瘤细胞、肿瘤相关巨噬细胞及树突状细胞,实现肿瘤杀伤、高效抗原呈递并逆转免疫抑制性TME。
文章链接:https://doi.org/10.1002/adfm.202526444
- 北京化工大学王兴教授团队《Adv.Healthc.Mater.》:基于双抗生素的pH响应型无载体纳米药物高效治疗混合细菌感染 2025-08-11
- 中山大学肿瘤医院杨江教授 JCR:可吸入式pH响应型电荷反转聚合物-siRNA复合物用于ALK融合阳性肺癌靶向基因治疗 2025-03-31
- 西安工程大学武海良教授、姚一军副教授 IJBM综述:环境响应型天然高分子基荧光材料研究进展 2024-01-18
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学史向阳教授团队:外泌体包裹的响应性树状大分子纳米凝胶可实现急性肺损伤的免疫调节和抗氧化联合治疗 2025-05-15
- 东华大学沈明武/史向阳团队《Acta Biomater.》:含磷树状大分子介导的生物矿化用于协同的肿瘤阻断治疗与乏氧激活化疗 2025-04-28
- 华科大李子福教授 Nat. Commun.:相变纳米凝胶赋能生物医学新突破 2025-12-22
