2025年3月,中山大学杨江研究员团队在《Journal of Controlled Release》上在线发表了题为《Inhalable pH-responsive charge-reversal polymer-small interfering RNA polyplexes for directed gene therapy of anaplastic lymphoma kinase fusion-positive lung cancer》研究性论文。该研究针对间变性淋巴瘤激酶(ALK)融合阳性非小细胞肺癌(NSCLC)的治疗挑战,开发了一种可吸入的pH响应型电荷反转聚合物-siRNA复合物(PPH)。传统ALK酪氨酸激酶抑制剂存在耐药性和副作用问题,而RNA干扰(RNAi)技术因siRNA递送效率低和稳定性差难以应用。研究团队设计了一种由聚乙二醇(PEG)、聚β-氨基酯(PBAE)和组氨酸组成的PPH聚合物,通过静电作用自组装形成纳米复合物。该载体在碱性胸膜液中保持负电荷以保护siRNA,在肿瘤微酸性环境中转为正电荷,促进细胞摄取和溶酶体逃逸。PPH-siRNA复合物在体外显著提高siRNA稳定性,在ALK+ NSCLC细胞(H3122)中,PPH介导的siALK递送有效抑制ALK表达,阻断下游MAPK和PI3K-AKT信号通路,并能显著抑制原位肺癌异种移植瘤的生长。该研究的创新性地将pH响应电荷反转机制与吸入式递送相结合,解决了siRNA肺部递送的关键难题,兼具靶向性、稳定性和生物安全性,为RNAi治疗ALK+ NSCLC提供了新策略,同时也为其他呼吸系统疾病的核酸药物递送开辟了新路径。这种非病毒载体平台的技术突破,有望推动基因治疗在临床中的转化应用。
研究亮点
(1)pH响应电荷反转递送系统:开发了PPH聚合物,该聚合物在碱性胸膜液中呈阴离子以保护siRNA,而在酸性肿瘤微环境中转变为阳离子,增强细胞摄取和溶酶体逃逸,实现精准控释。
(2)高效基因沉默与低毒性:通过分子动力学模拟和实验验证,PPH与siRNA形成稳定复合物,体外转染效率媲美商业PEI但毒性更低。体内实验显示,吸入PPH-siALK显著抑制ALK+肺癌生长(肿瘤抑制率84.5%),并下调MAPK/PI3K-AKT信号通路。
(3)非侵入性吸入给药策略:首次实现siRNA的吸入式递送,药代动力学表明药物主要富集于肺部,减少全身暴露。呼吸功能测试证实治疗改善肺通气,且血液学与组织学评估显示优异生物安全性,为肺癌靶向治疗提供新范式。
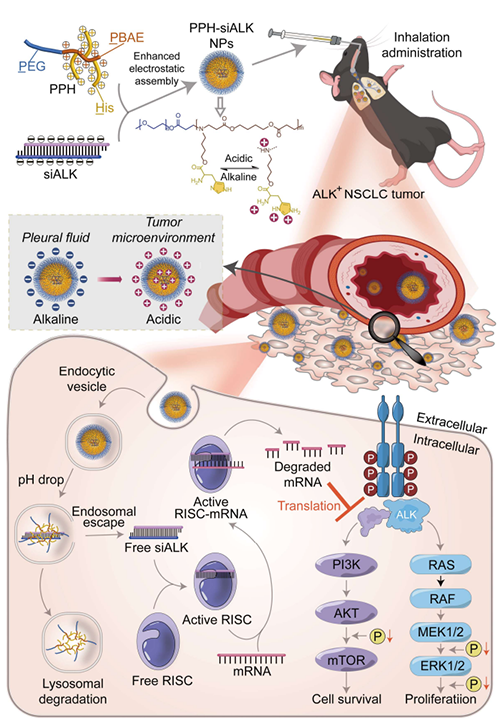
图1. 通过双正电荷的 PBAE 和 His 增强电荷反转的 PPH-siALK 多聚复合物的静电共组装,实现针对 ALK+非小细胞肺癌的 siRNA 指导的吸入式 ALK 基因沉默。
为了应对ALK阳性肺癌治疗的挑战,研究人员通过迈克尔加成反应将聚β-氨基酯(PBAE)接枝到聚乙二醇(PEG)链段,并进一步引入组氨酸(His)以增强质子缓冲能力。核磁共振氢谱和二维相关谱验证了合成步骤的完成,特征峰消失表明成功脱保护。傅里叶变换红外光谱显示PBAE和His的特征振动峰,进一步确认分子结构。凝胶渗透色谱测得不同分子量PPH(2k/5k/10k)的分散指数在1.36-1.86之间,证明聚合物均一性良好。pH滴定实验表明PPH具有显著的质子缓冲能力,在酸性条件下(pH~5.0)触发电荷反转,透光率测试显示其pH响应性相变行为。该设计通过PEG的“隐形”效应与PBAE/His的电荷调控特性,实现了siRNA在生理环境中的稳定包载及肿瘤微酸环境下的靶向释放。
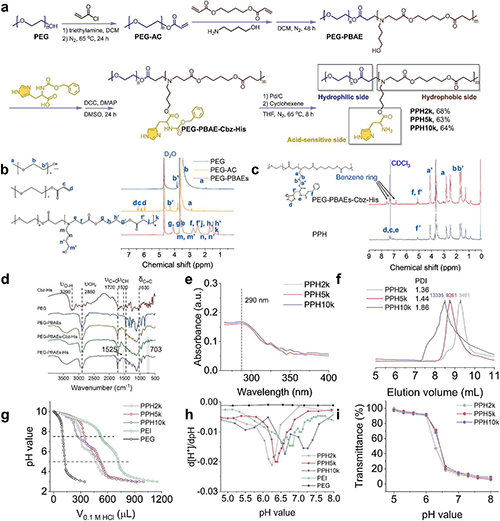
图2. PPH的化学合成与表征。
通过TEM和动态光散射分析发现,不同分子量(2k/5k/10k)的PPH自组装形成尺寸均一的纳米颗粒。随着N/P比从10增至40,复合物表面ζ电位由-15mV逆转为+8mV,在pH5.0时进一步升至+12mV,展现显著pH响应性电荷反转特性。电泳迁移实验证实PPH2k在N/P≥2时即可完全包裹siRNA,并能有效抵抗RNase I降解,证实了PPH可以在生理环境中有效保护siRNA并能在酸性的肿瘤微环境中打开并释放siRNA。
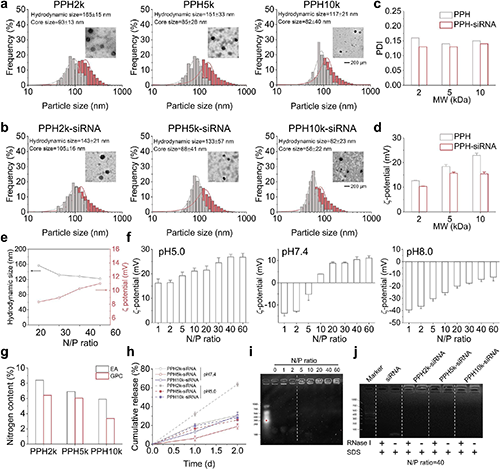
图3. PPH复合物的pH响应性、电荷反转和核酸酶降解保护。
分子动力学模拟显示,PPH与siRNA的结合稳定性显著优于传统聚合物PEG-PBAE,PPH-siRNA体系的均方根偏差(RMSD)波动较小,且回旋半径更小,表明其复合物结构更紧凑、结合更牢固(图4)。通过拉伸分子动力学(SMD)模拟发现,PPH脱离siRNA所需外力峰值更高(0.4 ns时达最大值),且脱离后仍残留组氨酸与siRNA的相互作用,证实其结合模式以盐桥(磷酸骨架-胺基/咪唑环)和氢键(核碱基)为主。相比之下,PEG-PBAE因缺乏组氨酸的质子缓冲能力,与siRNA的静电和疏水作用较弱,导致复合物稳定性差。该结果从分子层面揭示了PPH通过双正电荷模块增强siRNA负载效率的机制,为其高效的pH响应释放提供了理论依据。
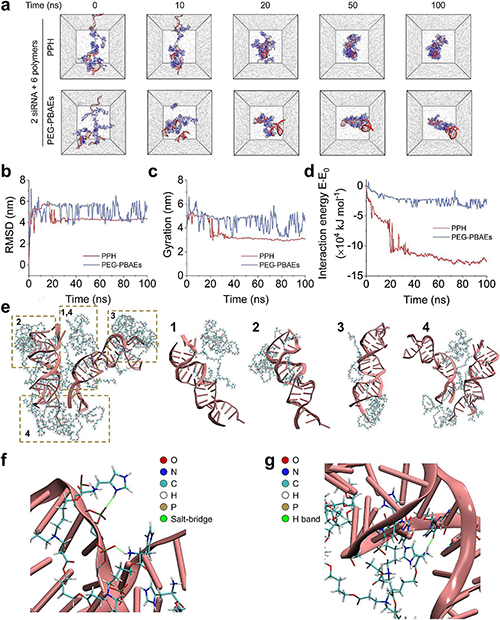
图4. 聚合物与siALK分子相互作用的分子动力学模拟。
进一步研究了PPH-siRNA复合物的体外转染效率及体内药代动力学特性。通过FITC标记siRNA的荧光成像和流式定量分析发现,随着N/P比从20升至60,H3122细胞的转染效率逐步提高,最终确定N/P=40为最优配比。共聚焦图片显示,PPH-siRNA复合物在进入细胞后主要定位于溶酶体,但120分钟后出现显著的溶酶体逃逸现象,胞质内荧光呈现弥散分布,证实其pH响应特性可促进核酸释放。药代动力学研究显示,吸入给药的半衰期与静脉注射相当,但生物分布特征显著不同:吸入组在肺部呈现特异性累积,而静脉注射组主要分布于肝脏。两种给药途径的AUC0-48h均达到90 %ID·h/g以上,表明PPH载体系统通过吸入途径既能维持系统暴露量,又可实现精准的肺部靶向递送,为减少全身毒性提供了重要依据。
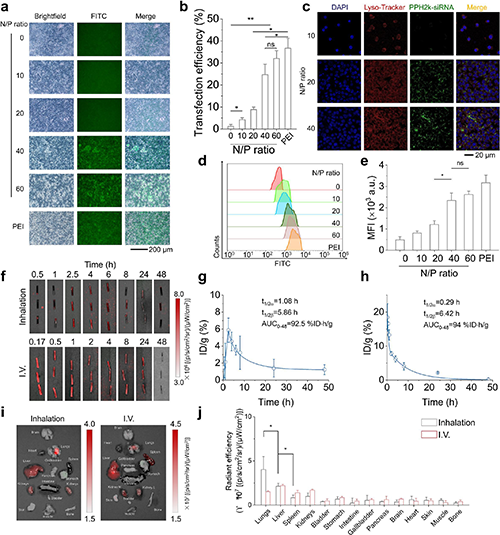
图5. 复合物在H3122细胞中的转染效率、药物动力学与生物分布。
体外实验显示,PPH载体相较于传统聚乙烯亚胺(PEI)展现出显著降低的细胞毒性,同时能高效递送siRNA实现靶向ALK基因沉默。该复合物通过特异性抑制ALK蛋白表达,有效阻断下游PI3K/AKT和MAPK/ERK信号通路的活化,从而显著抑制肿瘤细胞的增殖能力、克隆形成潜力以及迁移侵袭特性。Western blot分析进一步证实,PPH介导的RNA干扰不仅选择性降低ALK表达水平,还对MEK、ERK、AKT等关键信号分子的磷酸化具有显著抑制作用,揭示了其通过多通路协同发挥抗肿瘤效应的分子机制。这些发现为PPH载体在基因治疗中的高效性和安全性提供了重要实验依据。
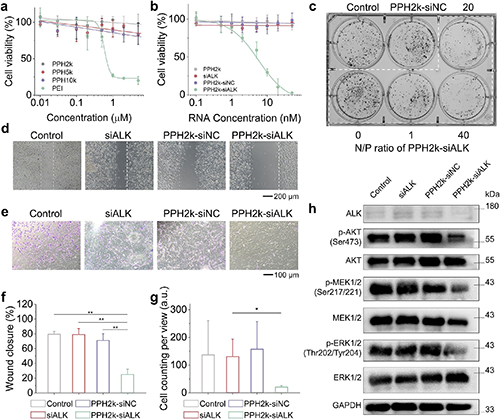
图6. PPH2k介导的siRNA定向ALK基因沉默并抑制H3122细胞的生长。
在小鼠原位肺癌异种移植模型中,通过吸入给药的PPH-siRNA复合物能有效靶向肺部肿瘤,显著抑制ALK+ NSCLC肿瘤的生长并延长荷瘤小鼠生存期(图7),同时通过系统性肺功能测试证实其对呼吸参数无明显不良影响,未引发气道阻塞或炎症损伤,表明该吸入式基因疗法在高效抑制肿瘤的同时具备良好的肺部安全性(图8)。组织学分析证实其通过特异性抑制ALK表达及下游信号通路发挥抗肿瘤作用,且未观察到主要器官的病理损伤,表明该吸入式基因递送系统兼具靶向性、有效性和生物安全性。

图7. PPH递送siALK抑制了H3122肺癌的生长。
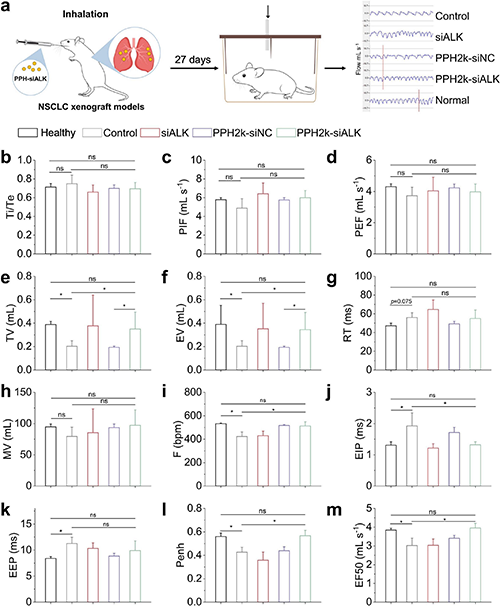
图8. PPH-siALK的治疗有效缓解了肺癌模型小鼠的肺功能。
综上所述,研究团队通过设计pH响应型电荷反转聚合物-siRNA复合物(PPH)并结合吸入式递送策略,为ALK融合阳性非小细胞肺癌的RNA干扰治疗提供了创新性解决方案,尤其在实现靶向递送、增强siRNA稳定性和克服传统酪氨酸激酶抑制剂耐药性方面,展现出了显著的临床转化潜力。
原文链接:https://doi.org/10.1016/j.jconrel.2025.113644
通讯作者简介
邢蔚,中山大学肿瘤防治中心手术麻醉科副主任,主任医师、博士生导师,美国弗吉尼亚大学麻醉科访问学者,以第一作者和通讯作者在Anesthesiology, British Journal of Anaesthesia等期刊发表论文30余篇,其中发表于Anesthesiology的论著成为当期封面。
