肌腱损伤是临床常见且极具挑战性的组织损伤问题,现有修复手段难以恢复肌腱天然的层级结构和生物力学性能,且易引发术后黏连、炎症、感染等并发症。
近日,兰州大学范增杰教授团队开发出一种3D打印具有仿生梯度与动态适应性的压电水凝胶支架。该支架融合荷叶仿生抗黏连结构与力学、压电、降解三梯度设计,以PHBV/SA/PAM为核心材料体系,通过微纳光固化与墨水直写式3D打印技术精密构筑,实现了自供电电刺激、阶段化力学支撑、时空可控降解的协同功能。该支架可有效下调促炎因子、促进M2型巨噬细胞极化、抑制细菌增殖,同时显著提升I型胶原沉积与纤维定向排列,在大鼠急性跟腱损伤模型中实现了肌腱的功能化再生修复。转录组与机器学习分析揭示,支架通过调控p38MAPK、IKKβ/NF-κB等多条信号通路,实现抗炎、抗黏连、促胶原重塑的多效调控,为肌腱损伤的临床治疗提供了全新的仿生材料策略。
2026年2月9日,相关工作以A 3D-Printed Piezoelectric Scaffold With Bio-Inspired Gradient and Dynamic Adaptation for Tendon Regeneration为题发表在 《Advanced Materials》上。
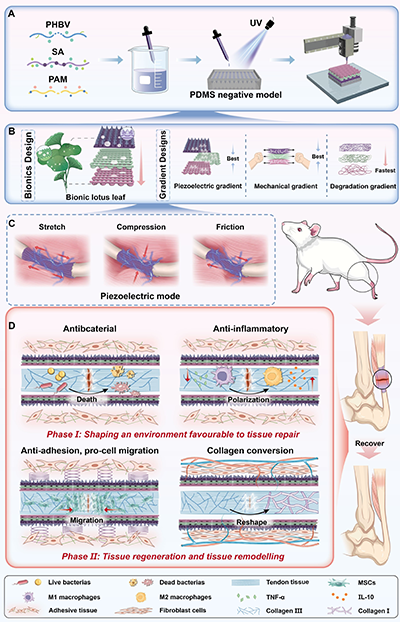
图1. 自适应梯度支架(GS)的设计与制造
一、临床痛点:肌腱损伤修复的多重难题亟待突破
肌腱作为连接肌肉与骨骼的关键组织,具有低细胞密度、血供差的生理特点,损伤后自愈能力极弱,易形成瘢痕组织并伴随术后黏连、慢性炎症、感染等问题,最终导致肌腱力学性能下降、关节功能障碍,成为临床骨科与运动医学的难治性疾病。
目前临床常用的肌腱修复手段以手术缝合为主,辅以传统支架材料,但这类材料存在明显短板:一是静态性能无法匹配肌腱动态愈合过程,肌腱愈合的炎症期、增殖期、重塑期对力学支撑、生物信号调控的需求差异显著,传统材料难以实现阶段化适配;二是缺乏有效的抗黏连与抗感染设计,术后周围组织黏连是导致肌腱功能恢复不佳的主要原因,而临床抗菌手段易破坏局部免疫微环境;三是外源性电刺激需依赖外部电源,生物电信号是调控肌腱细胞迁移、胶原合成的关键因素,但传统电疗设备的有创性与便携性问题限制了临床应用。
针对上述痛点,兰州大学范增杰教授团队提出“仿生梯度+动态适配”的设计理念,开发出集自供电压电刺激、仿生抗黏连、多梯度时空调控于一体的3D打印支架,从材料设计、结构构筑、功能调控三个层面解决肌腱修复的核心难题。
二、核心创新:四重仿生设计,打造肌腱修复的“智能适配支架”
团队的核心设计亮点在于将荷叶仿生抗黏连结构与力学、压电、降解三梯度相结合,同时实现亲水-疏水界面梯度调控,四重设计相互协同,让支架能够精准匹配肌腱的天然生理特征与动态愈合需求,具体设计如下:
1. 荷叶仿生抗黏连结构:借鉴荷叶超疏水、自清洁的微纳层级结构,通过微纳光固化3D打印技术在支架外层构筑锥形针状微结构(高度100-120 μm,基底直径100 μm),并经三氯十八烷基硅烷疏水改性,使支架外层接触角达126.3°,形成物理屏障,有效阻断成纤维细胞与外周组织的黏附,从根源上解决术后黏连问题;而支架内层保持亲水特性(接触角23.9°),为内源性干细胞的黏附、增殖提供良好微环境,实现“外抗黏连、内促再生”的双向调控。
2. 力学梯度设计:模仿天然肌腱的力学梯度特征,通过调控压电材料PHBV的浓度,使支架中层具有最高的力学强度(拉伸应力达2 MPa,压缩应力6 MPa),有效分散张力、减少应力集中,避免支架在肌腱运动过程中断裂。内层与外层力学性能逐级递减,匹配损伤肌腱的力学修复规律,同时支架具备优异的柔韧性与抗弯曲能力,可支撑1.0kg载荷,满足体内动态力学环境的需求。
3. 压电梯度设计:以生物相容性与可降解性优异的PHBV为压电核心材料,通过浓度梯度调控实现支架压电输出的阶段化适配。愈合早期,支架中层较高浓度PHBV产生强电刺激,主要发挥抗炎、调控免疫微环境的作用;愈合后期,随着内、中层降解,外层低强度电刺激暴露,精准调控胶原重塑与纤维定向排列。该支架无需外部电源,可通过肌腱的拉伸、压缩、摩擦等生理运动实现自供电动态压电刺激,完美模拟天然肌腱的生物电微环境。
4. 降解梯度设计:遵循肌腱“由内向外”的天然愈合模式,支架内层PHBV浓度低、降解速度快,为新生肌腱组织的长入创造空间;外层PHBV浓度高、降解缓慢,长期提供力学支撑与抗黏连屏障;中层降解速率居中,实现支架降解与组织再生的时空同步,避免支架残留或过早失去支撑作用。
同时,团队通过优化溶剂体系(水:DMF:DCM=6:1:3),解决了疏水PHBV与亲水SA/PAM水凝胶的相容性难题,成功制备出均相稳定的压电水凝胶体系,为3D打印的精准构筑奠定了材料基础。
三、精密构筑:多技术融合3D打印,实现支架的结构与性能精准调控
支架的成功制备依赖于微纳光固化 3D 打印与墨水直写3D 打印的技术融合,团队通过一系列工艺优化,实现了支架微纳结构、梯度分布与成型精度的精准控制:
1. 模具制备:利用3ds Max设计5 cm×5 cm仿生阵列,通过微纳3D打印制备树脂阳模,再经PDMS翻制阴模,实现荷叶仿生微结构的规模化、可重复制备;
2. 墨水优化:确定SA、AM、PHBV的最优浓度(6%、12%、2%-8%),所制备的PHn水凝胶具有良好的剪切稀化特性,可顺利通过3D打印喷嘴,且储能模量始终大于损耗模量,保证打印过程中支架的结构稳定性;
3. 梯度成型:采用墨水直写3D打印技术,通过逐层调控PHBV浓度(内层2%、中层4%、外层8%),实现力学、压电、降解三梯度的一体化构筑,层间结合紧密,可适应体内复杂的力学载荷;
4. 后处理改性:打印后经Cacl?交联提升力学稳定性,外层经OTS疏水改性实现超疏水特性,最终获得结构精密、性能可控的梯度压电支架(tGS)。
扫描电镜(SEM)与能谱分析(EDS)结果显示,支架各层孔径均匀,元素分布均一,荷叶仿生微结构成型精准,为支架的体内外性能发挥提供了结构保障。
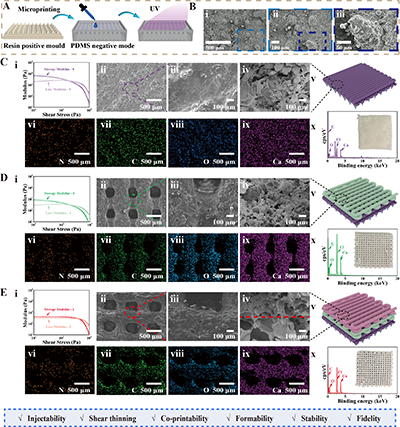
图2. GS的设计与3D打印制备
四、性能表征:支架兼具优异的理化性能、生物相容性与抗菌活性
团队对支架的理化性能、生物相容性、抗菌活性进行了系统表征,验证了其作为肌腱修复材料的可行性:
1. 理化性能优异:支架的压电输出可随肌腱生理应变(1%-5%)动态调控,PH4层输出电压最高,且在拉伸、压缩、摩擦三种生理运动模式下均能稳定产电;水含量、溶胀率随 PHBV 浓度梯度变化,外层低溶胀率保证抗黏连性能,内层高溶胀率利于营养物质运输;28天降解实验显示,支架降解率随PHBV浓度升高而降低,实现了从快到慢的梯度降解,匹配肌腱愈合的时间进程。
2. 生物相容性良好:活/死染色与MTT实验表明,支架浸提液对骨髓间充质干细胞(BMSCs)无细胞毒性,且能促进细胞增殖;溶血率均低于5%,符合临床应用标准;大鼠皮下植入实验显示,支架可有效调控炎症反应,术后3周炎症细胞浸润显著减少,胶原纤维排列规则,表现出优异的体内生物相容性。
3. 广谱抗菌活性:平板计数法结果显示,支架的抗菌活性随PHBV浓度升高而增强,PH8 层对大肠杆菌的抑制率达100%,对金黄色葡萄球菌抑制率超99%,对临床难治的耐甲氧西林金黄色葡萄球菌(MRSA)与铜绿假单胞菌(PA)也具有显著抑制效果(抑制率分别约75%、84%)。其抗菌机制主要为压电效应产生的电子与活性氧(ROS)破坏细菌细胞膜,实现无抗生素的物理抗菌,避免细菌耐药性问题。
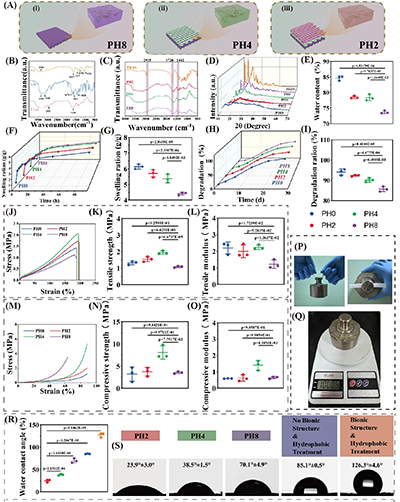
图3. PHn的制备及表征
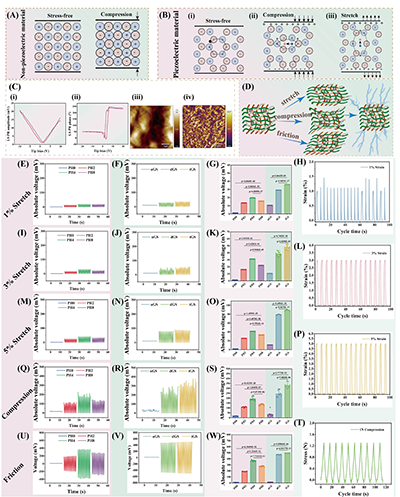
图4.PHn与GS的压电性能表征
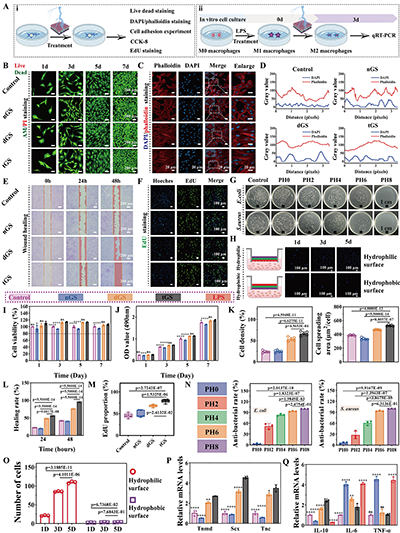
图5.生物学性能及抗菌性能表征
五、体内外验证:多效调控实现肌腱的功能化再生修复
团队通过体外细胞实验与大鼠跟腱损伤模型体内实验,全面验证了支架的肌腱修复效果,结果显示该支架可实现抗炎、抗黏连、促再生、恢复力学功能的多效调控:
1. 体外细胞实验:激活肌腱再生相关通路,抑制炎症反应:细胞骨架染色、划痕实验与EdU检测表明,支架的压电刺激可促进BMSCs的伸长、迁移与增殖,细胞铺展面积与增殖率显著高于对照组;qRT-PCR结果显示,支架可显著上调肌腱特异性标志物(Tnmd、Scx、Tnc)的表达,同时下调促炎因子TNF-α、IL-6的表达,上调抗炎因子IL-10的表达,促进RAW264.7细胞向M2型巨噬细胞极化,营造有利于肌腱再生的抗炎微环境。
2. 体内动物实验:实现肌腱结构与功能的双重恢复:大鼠跟腱3mm缺损模型实验中,术后1周与3周的大体观察显示,tGS组肌腱周围无明显黏连组织,而对照组与无压电成分支架组(nGS)存在严重的纤维组织黏连;H&E与Masson染色结果表明,tGS组缺损区域被新生组织完全填充,胶原纤维呈波浪状定向排列,与天然肌腱结构高度相似,而对照组胶原纤维排列紊乱,瘢痕组织大量形成。
步态分析与生物力学测试进一步验证了支架的功能修复效果:术后3周,tGS组大鼠跟腱的运动功能指数(AFI)显著优于其他组,爪印长度、宽度与正常侧无显著差异;生物力学测试显示,tGS组修复肌腱的弹性模量、最大拉伸应力等指标与天然肌腱接近,力学性能得到有效恢复。
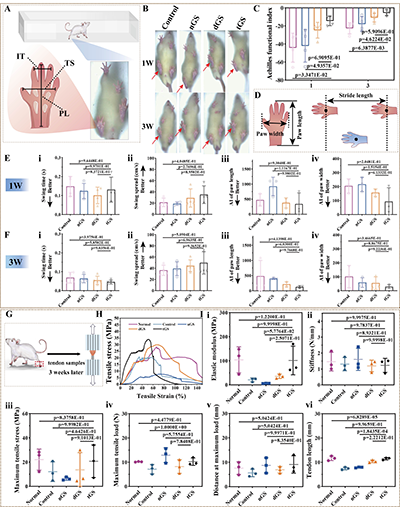
图6. 体内功能恢复评估
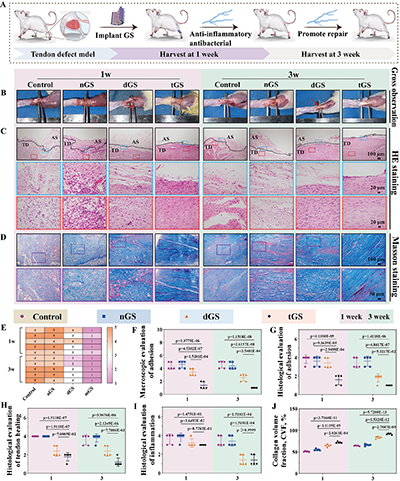
图7.GS修复肌腱的体内评估
六、机制解析:转录组+机器学习,揭示多通路协同调控的分子机制
为阐明支架促进肌腱再生的深层分子机制,团队对术后3周的再生肌腱组织进行了转录组测序,并结合机器学习算法分析炎症特征,结果表明:
1. 与对照组相比,tGS组有1376个差异表达基因,其中674个上调、702个下调,上调基因主要富集于机械转导、钙跨膜运输、胶原生物合成、组织重塑等通路,下调基因主要富集于炎症激活、氧化应激、成纤维细胞迁移等通路;
2. 支架通过显著抑制Ikkβ/NF-κB、p38MAPK、JAK-STAT等炎症相关信号通路,下调促炎因子表达,同时促进M2型巨噬细胞极化,极化指数达3.70倍,实现高效抗炎;
3. 支架的疏水外层可通过抑制ERK1/2信号通路,减少成纤维细胞的异常增殖与迁移,从分子层面抑制术后黏连;
4. 机器学习分析进一步证实,tGS组可显著激活M2型巨噬细胞的所有亚型,抑制M1型巨噬细胞的经典亚型,营造稳定的抗炎再生微环境,同时上调肌腱再生相关基因,促进胶原重塑与肌腱功能恢复。
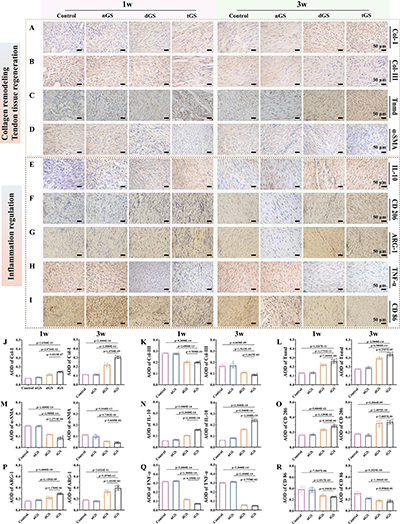
图8.术后1周和3周修复肌腱组织的免疫组织化学染色结果
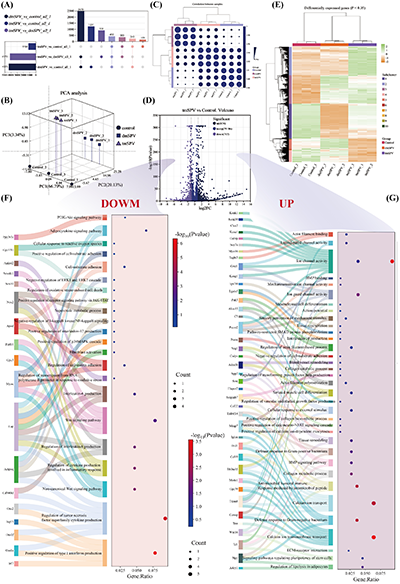
图9.转录组分析揭示梯度支架介导的肌腱再生机制
兰州大学范增杰教授团队开发的3D打印具有仿生梯度与动态适应性的压电支架,是肌腱组织工程领域的一项重要创新成果。该研究的核心突破在于将仿生结构设计与多梯度性能调控相结合,首次实现了自供电压电刺激、阶段化力学支撑、时空可控降解、亲水-疏水双向界面的一体化集成,解决了传统肌腱修复材料静态性能与动态愈合不匹配、术后黏连与感染难以兼顾、外源性电刺激有创性等关键问题。
该支架以PHBV/SA/PAM为核心材料,通过3D打印技术实现了结构与性能的精准调控,体内外实验证实其可有效调控炎症微环境、抑制术后黏连、促进肌腱特异性再生与力学功能恢复,转录组与机器学习分析进一步揭示了其多信号通路协同调控的分子机制。该研究为肌腱损伤的临床治疗提供了全新的仿生材料策略,也为其他软组织的再生修复提供了重要的设计思路。
该研究得到了国家自然科学基金、甘肃省联合研究基金、甘肃省自然科学基金等项目的资助,第一作者为兰州大学口腔医学院2022级硕士研究生黄欣悦,通讯作者为范增杰教授。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adma.202517298
- 中国海洋大学徐晓峰教授团队 AFM:吸湿复合材料同轴3D打印 2026-02-26
- 中科大/理化所董智超、中科大李储鑫 Adv. Mater.:3D打印旋转扇叶 - 低能耗吸雾除湿,并实现油雾稳定捕集 2026-02-02
- 南理工/国科大杭高院王杰平、南理工易文斌 Small:基于多功能光引发剂的可酸降解光固化3D打印材料 2026-01-19
- 上海交大张照明/颜徐州团队 Macromolecules:正交且协同的超分子作用助力提升材料性能 2025-11-27
- 上海交大颜徐州课题组 JACS:具有密集轮烷骨架的机械互锁气凝胶 2022-06-15
- 浙江大学王立教授/俞豪杰教授团队 Adv. Sci.:用于免缝合和高质量肌腱修复的Janus水凝胶 2025-02-12
- 燕山大学焦体峰、秦志辉/UCLA贺曦敏 AFM:具有良好生物相容性和抗溶胀特性的高强度、各向异性导电水凝胶作为人工电子肌腱 2023-12-25
