三阴性乳腺癌(TNBC)是乳腺癌中最具侵袭性和致死性的亚型,由于缺乏雌激素受体、孕激素受体和人表皮生长因子受体2的表达,导致传统激素疗法及靶向治疗失效,临床主要依赖化疗但存在疗效低、毒副作用显著等局限。联合治疗已成为近年来TNBC的新型疗法,如免疫治疗与化疗、放疗以及靶向治疗的组合,但存在免疫相关不良反应的风险。近年来,基于生物矿化的新型阻断疗法因其优良生物相容性和持续诱导矿化能力在肿瘤治疗领域备受关注。
生物矿化是生物体对无机物质成核、生长和定向组装进行精准调控,进而形成硬组织材料的过程。肿瘤靶向矿化阻断策略,创新性地将病理性矿化引入肿瘤治疗中。该策略主要依赖于羧基、双膦酸盐等基团作为矿化位点诱导肿瘤组织周围形成矿物质屏障,这层物理屏障能够有效阻断肿瘤细胞与周围微环境之间的营养代谢交换及信号分子传递,在乳腺癌、宫颈癌和骨肉瘤等恶性肿瘤治疗中展现出显著疗效。此外,纤连蛋白(Fibronectin, FN)含有的精氨酸-甘氨酸-天冬氨酸(RGD)序列能够特异性识别肿瘤细胞表面高表达的αvβ3整合素受体,兼具靶向识别性能和生物相容性。
肿瘤组织的矿化过程会导致局部血液供应减少,加重肿瘤的缺氧状态。这一特性可被用于激活生物还原性药物如替拉扎明(Tirapazamine, TPZ),促使其转化为具有细胞毒性的活性形式。通过合理设计和优化基于生物矿化的阻断治疗和乏氧激活化疗可以为TNBC联合治疗提供新的可能。
含磷树状大分子因其良好的生物相容性和可修饰性,表现出极佳的蛋白、药物的递送效率,被广泛用于肿瘤和炎症等疾病的治疗。尤其是,以双膦酸盐封端的含磷树状大分子不仅通过简单物理作用高效负载蛋白质,其末端基团还可作为矿化诱导位点。因此,设计基于双膦酸盐封端的含磷树状大分子纳米平台有望整合肿瘤特异性识别、矿化诱导和药物控释等功能为一体用于协同治疗TNBC。
为此,东华大学沈明武研究员/史向阳教授团队与法国国家科学研究中心Jean-Pierre Majoral院士团队合作构建了一种负载TPZ的含磷树状大分子/FN纳米复合物(图1)。研究团队以双膦酸盐封端的含磷树状大分子AK176为载体,通过氢键、阳离子-π及疏水相互作用将AK176与FN复合,进一步通过静电相互作用负载TPZ,得到AK176@FN/TPZ纳米复合物(AFT NCs)。所制备的AFT NCs具有良好的稳定性,能够通过FN介导的靶向作用识别肿瘤细胞,并以AK176末端的双膦酸盐基团作为钙沉积位点诱导生物矿化,加剧肿瘤乏氧微环境激活TPZ,实现TNBC的协同阻断治疗/乏氧激活化疗。
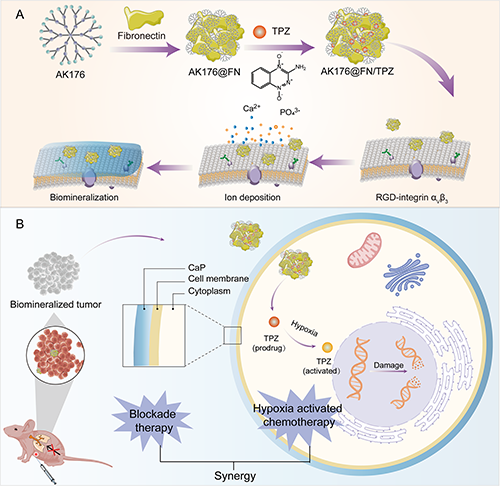
图1. AFT NCs的制备及其介导三阴性乳腺癌协同治疗机制。
TEM图像显示所制备的AF NCs和AFT NCs的形貌为均匀分散的球形结构,尺寸大小分别为102.9 nm和134.1 nm(图2A-B)。AFM图像显示AF NCs和AFT NCs的高度分别为15.6 nm和26.1 nm,初步证明TPZ在AF NCs中的成功负载(图2C-D)。此外,UV-vis图谱、SDS-PAGE图像以及表面电势进一步证明了FN和TPZ的成功负载(图2E-H)。AFT NCs的水合动力学尺寸为244.2 nm,PDI为0.21,表面电势为-10.8 mV(图2G-H)。
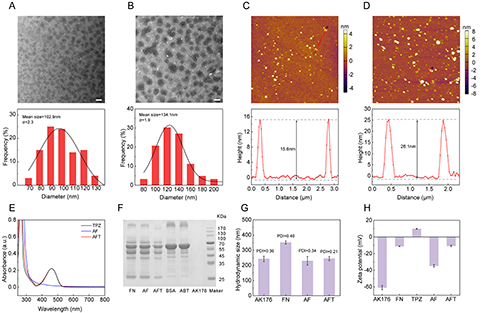
图2.(A)AF NCs和(B)AFT NCs的TEM图像及尺寸分布直方图;(C)AF NCs和(D)AFT NCs的AFM图像及高度分布图;不同材料的(E)UV-Vis图谱、(F)SDS-PAGE图谱、(G)水合粒径和(H)表面电势。
研究团队发现AFT NCs在30分钟孵育时间内能最大程度地定位在MDA-MB-231细胞膜表面(图3A),并通过FN介导的靶向作用特异性结合αvβ3整合素(图3B)。CLSM和共定位分析进一步证明,AFT NCs与细胞孵育30 min使纳米材料倾向于附着在细胞膜表面而非内化(图3C-D)。AFT NCs的双膦酸盐基团可有效诱导癌细胞膜表面的生物矿化,在无外源钙补充条件下,AFT NCs能利用培养基中的钙形成磷酸钙矿化层,表现为明显的钙黄绿素相关的绿色荧光信号(图3E),而额外补充钙的AFTC组矿化效果更明显(图3F)。EDX分析显示,矿化层由无序的钙磷沉积物组成,Ca/P比接近羟基磷灰石理论值(图3G-H)。此外,AFTC处理可特异性降低MDA-MB-231细胞培养液的钙浓度(图3I-J),表明AFT NCs能够定位到肿瘤细胞表面并吸附外源性钙离子,实现肿瘤靶向生物矿化。
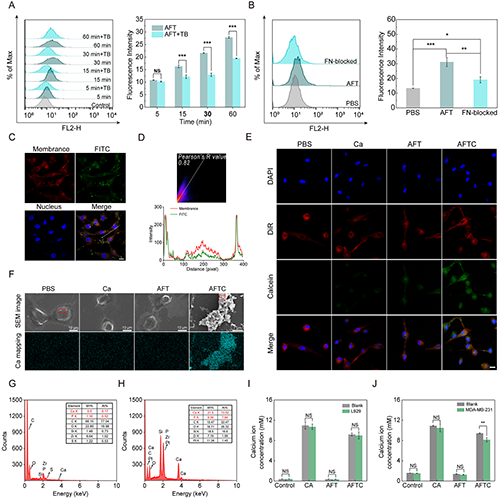
图3.(A)MDA-MB-231细胞与AFT-FITC共孵育不同时间,台盼蓝淬灭前后的荧光强度流式细胞图;MDA-MB-231细胞与AFT-FITC共孵育30分钟后的(B)流式细胞图和(C)CLSM图像;(D)细胞膜与AFT-FITC的共定位分析:烟花图像及皮尔逊相关系数;(E)经不同处理后MDA-MB-231细胞表面CaP层的CLSM图像;(F)经不同处理后MDA-MB-231细胞的SEM图像及钙元素分布图;(G-H)PBS和AFTC处理后MDA-MB-231细胞的EDX能谱图;经不同处理后(I)L929细胞和(J)MDA-MB-231细胞上清液中Ca2+浓度。
接下来,研究团队通过一系列体外实验探究AFT NCs介导的生物矿化策略的抗肿瘤机制(图4A)。由于FN介导的靶向作用,AFTC诱导的细胞表面矿化能显著抑制MDA-MB-231细胞的增殖,而对正常L929细胞无明显影响(图4B)。进一步研究发现,生物矿化处理后的MDA-MB-231细胞凋亡率显著增强(图4C),同时其迁移和侵袭能力也受到抑制,且该抑制效果随着钙离子补充而增强(图4D-I)。这些结果表明,外源钙离子的补充促进AFT NCs的生物矿化的效果,抑制细胞内氧气和能量的运输,从而激活乏氧前药TPZ的化疗活性,导致有效的癌细胞凋亡和抗迁移/侵袭能力,为AFT NCs在体内抑制肿瘤增殖和转移提供了依据。

图4.(A)生物矿化处理MDA-MB-231细胞的示意图;(B)经不同处理后L929和MDA-MB-231细胞的细胞活力图;经不同处理后MDA-MB-231细胞的(C)凋亡流式分析图、(D-E)划痕实验、(F-G)Transwell迁移实验及(H-I)Transwell侵袭实验的代表性图像和定量数据。
随后,研究团队通过RNA测序揭示了AFTC诱导的细胞表面矿化作用机制。转录组分析显示,AFTC处理组与PBS组存在487个差异表达基因(176个上调,311个下调)(图5A)。KEGG富集分析表明,矿化作用主要通过影响IL-17、PI3K-Akt、HIF-1α等信号通路,以及细胞黏附因子和代谢合成来诱导细胞死亡(图5B-C)。GO分析显示差异基因显著富集于“生物调控”、“代谢过程”、“缺氧响应”等生物学过程(图5D-E)。热图显示,AFTC组中EDN2、NOX5等促迁移基因表达下调,而TNFSF14等促凋亡基因表达上调(图5G)。这些结果说明AFTC诱导的膜矿化通过破坏代谢稳态、诱导凋亡和抑制迁移等多途径发挥抗肿瘤作用。
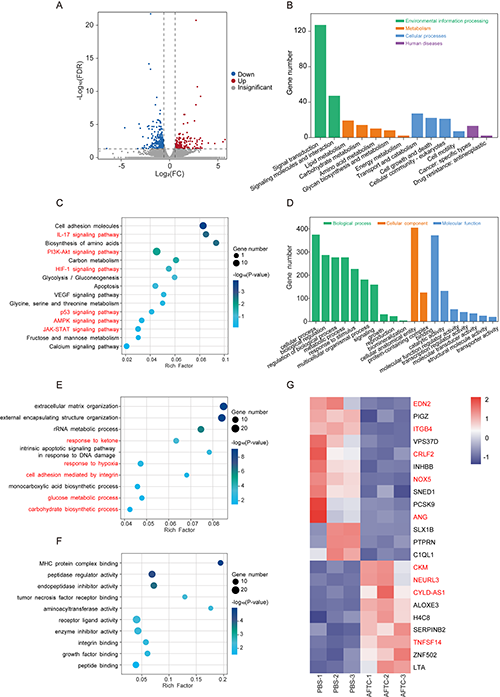
图5.(A)PBS和AFTC处理后MDA-MB-231细胞的差异表达基因火山图;差异表达基因(B)KEGG注释分类及(C)富集分析;差异表达基因(D)GO注释分类及(E)生物学过程、(F)分子功能层面的富集分析;(G)|log2(FC)|≥1.5的代表性差异表达基因热图。
研究团队通过构建MDA-MB-231三阴性乳腺癌原位移植瘤模型验证AFT NCs的体内治疗效果(图6A)。在图6B-C中,AFTC可通过增强的生物矿化作用协同加剧肿瘤缺氧来激活TPZ,从而显著抑制肿瘤生长。ICP-OES检测显示AFT和AFTC组肿瘤组织钙含量显著升高(图6D)。Micro-CT成像进一步证实AFT NCs介导的生物矿化能在肿瘤组织周围作用形成致密的矿物层(图6E-F)。总的来说,通过生物矿化介导的阻断治疗与缺氧激活化疗的协同作用,实现了显著的体内抗肿瘤效果。
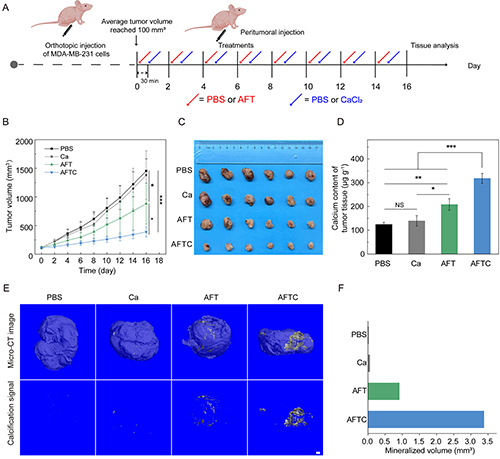
图6.(A)原位三阴性乳腺癌异种移植模型的治疗时间线;(B)治疗期间各组小鼠肿瘤体积变化;治疗后各组小鼠(C)肿瘤代表性照片、(D)肿瘤组织的钙含量、(E)肿瘤组织Micro-CT成像图及(F)矿化体积定量结果。
研究团队通过组织学分析揭示了AFT NCs的体内抗肿瘤机制。治疗后小鼠肿瘤组织坏死区域增加、增殖指标(Ki-67)减少、凋亡指标(caspase-3)增加和乏氧指标(HIF-1α)表达增加,表明矿化作用加剧了肿瘤微环境的缺氧,从而激活TPZ的化疗活性(图7A-B)。此外,存活率和肺转移实验进一步表明,AFT NCs介导的生物矿化策略能够增加小鼠的存活率及有效抑制体内肿瘤肺转移(图7C-D)。

图7.治疗后各组小鼠肿瘤组织的(A)H&E染色及(B)Ki-67、Caspase-3和HIF-1α免疫荧光染色结果;(C)治疗后各组小鼠的生存率;(D)治疗后各组小鼠肺组织的代表性照片及H&E染色结果。
简而言之,该研究设计的负载TPZ的含磷树状大分子/FN纳米复合物(AFT NCs)具有多个优势:1)AK176末端的双膦酸盐基团可作为钙沉积的诱导位点;2)含磷树状大分子共负载FN和TPZ,不仅能实现肿瘤靶向生物矿化,还能通过加剧肿瘤乏氧微环境激活TPZ的化疗活性;3)所构建的AFT NCs具有肿瘤特异性阻断治疗与化疗协同效应,可有效抑制TNBC进展与转移。这项研究为TNBC治疗提供了一种新型的生物矿化策略,有望应用于治疗其他恶性肿瘤。
以上研究成果以“Phosphorous Dendrimer-Mediated Biomineralization for Synergistic Blockade Therapy and Hypoxia-Activated Chemotherapy of Tumors”为题,在线发表于国际著名期刊Acta Biomaterialia (DOI: 10.1016/j.actbio.2025.04.038)。东华大学生物与医学工程学院沈明武研究员、史向阳教授与邹瑜(博士后)为共同通讯作者,东华大学硕士研究生梁佳佳为第一作者。该工作得到了国家重点研发计划项目、国家自然科学基金项目、上海市科委项目等的资助。
文章链接:https://doi.org/10.1016/j.actbio.2025.04.038
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学史向阳教授团队 Nano Today:基于含磷树状大分子的药物递送系统协同增强自噬、抗炎和抗氧化治疗阿尔茨海默症 2025-02-11
- 东华大学沈明武/史向阳Biomaterials:具有生物活性的含磷树状大分子共递送蛋白质/药物用于巨噬细胞重编程增强骨关节炎治疗 2024-12-09
- 西南交大王勇教授等 Macromolecules:受生物矿化启发的超强韧自愈合水性聚氨酯弹性体 2025-10-03
- 华东师大张利东教授、周立旻教授团队 Carbohyd. Polym.:微生物矿化技术-打造生物可降解的超疏油海藻酸盐水凝胶中空管 2025-03-10
- 四川大学杨刚教授团队 ACS AMI:受生物矿化启发的限域生长策略制备高性能聚酰亚胺气凝胶 2024-01-11
