顺铂(Cis)是治疗各种恶性肿瘤最有效的化疗药物之一,然而其严重的副作用限制了其应用,即使是单剂量的顺铂也能够引起急性肾损伤,这是因为肾脏在顺铂排泄过程中会产生活性氧/氮物质(RONS)损害肾细胞的结构和功能。肾脏排泄受损会进一步加剧毒素积累,使肾脏损伤永久化,并形成威胁癌症患者生命的恶性循环。当顺铂在体内诱导氧化应激损伤时,导致大量 RONS 积累,进而引发严重的炎症反应和细胞凋亡,RONS 的增加强烈促进了脂质过氧化物的积累,从而导致“铁死亡风暴”。到达肾脏的全身给药治疗药物可以迅速清除,从而缩短肾脏暴露时间,这可能不足以达到治疗效果。因此,开发针对肾脏的药物递送系统去除AKI期间过量产生的RON并恢复肾氧化还原稳态对于减少肾损伤、炎症和抑制铁死亡至关重要,从而提高肾脏疾病药物的治疗指数和安全性至关重要。
M2FPPF@Cur治疗急性肾损伤示意图
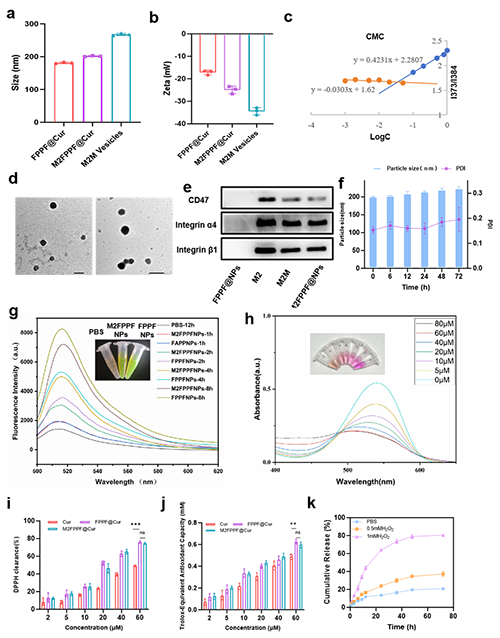
图 1.M2FPPF@Cur的制备和表征。(a)FPPF@Cur M2FPPF@Cur的尺寸分布和(b)由DLS确定的zeta电位。(c)FPPF的CMC特性。(d)FPPF@Cur和M2FPPF@Cur的代表性TEM 图像,比例尺 = 100 nm。(e)巨噬细胞、M2M和M2FPPF@Cur中特异性蛋白条带(CD47和整合素α4/β1)的蛋白质印迹分析。(f)72 小时内M2FPPF@Cur粒径和PDI 的变化。(g) M2FPPF@FDA与50μM H2O2孵育不同持续时间后的荧光。(h)M2FPPF@Cur的?NO清除能力。(i)和(j)通过 DPPH和ABTS测定测量的M2FPPF@Cur的自由基清除能力。(k)在不同H2O2浓度(0 mM、0.5 mM 和 1 mM下 FPPF@Cur的Cur累积释放量。使用单因素方差分析(n = 3)计算统计显著性。P 值: **P < 0.01,***P < 0.001。
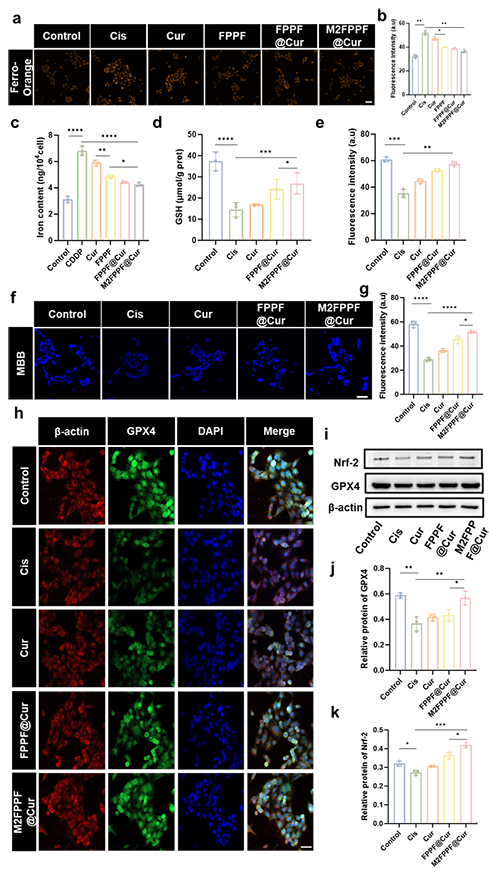
图2.M2FPPF@Cur减少细胞质不稳定的铁并调节GPX4以抑制HK-2细胞中的铁死亡。(a)和(b)用FerroOrange染色的 HK-2 细胞的图像和定量。比例尺 = 100 μm。(c)使用铁检测试剂盒检测 HK-2 细胞中的铁含量。(d)使用GSH检测试剂盒测量 HK-2 细胞中的GSH 水平。(e)和(f)MBB染色的HK-2细胞的图像和定量。比例尺 = 100μm。(g)和(h)HK-2细胞中GPX4的免疫荧光图像和定量。比例尺=100μm。(i)、(j)和(k)Nrf2和GPX4 蛋白表达的蛋白质印迹分析和定量。通过单因素方差分析计算统计显着性(n = 3)。P 值:*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。
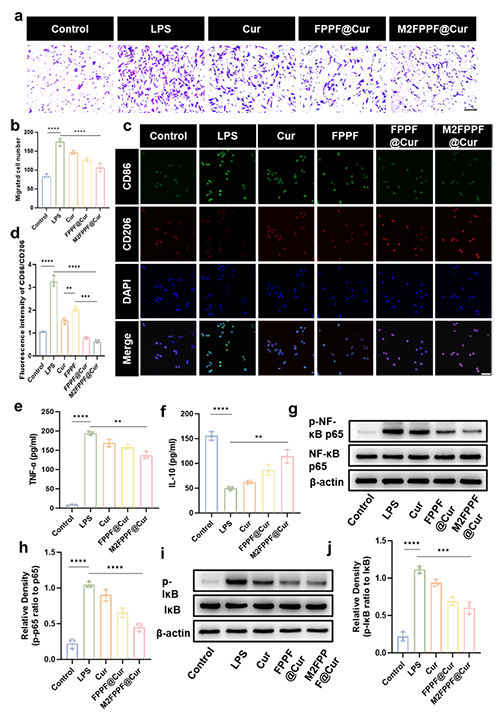
图3.M2FPPF@Cur 在体外调节巨噬细胞极化和 NF-κB 通路。(a)和(b)活化的巨噬细胞诱导的巨噬细胞迁移的代表性图像和定量分析。比例尺 = 100 μm。(c)和(d)与各种处理共培养的 RAW264.7 细胞中 CD86 和 CD206 的免疫荧光染色。比例尺 = 100 μm。(e)细胞上清液中的 TNF-α 水平(f)细胞上清液中的 IL-10 水平。(G-J)对 Cur、FPPF@Cur 和 M2FPPF@Cur 处理的 LPS 活化的 RAW264.7 细胞中的 IκB、p65、p-IκB 和 p-p65 蛋白进行蛋白质印迹分析。通过单因素方差分析计算统计显着性 (n = 3)。P 值:*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。
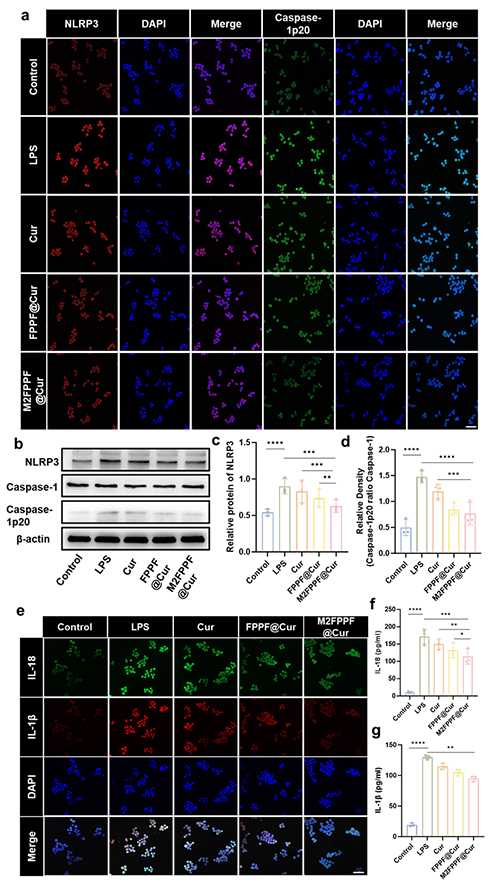
图4.M2FPPF@Cur抑制NLRP3炎性小体激活(a)NLRP3和Caspase-1p20的免疫染色图像。比例尺= 100 μm。(b)、(c)和(d)NLRP3和 Caspase-1p20的蛋白质印迹分析和定量。(e)RAW264.7 细胞中IL-1β和IL-18的免疫荧光图像。比例尺= 100μm。(f)细胞上清液中的IL-1β水平。(g)细胞上清液中的IL-18 水平。使用单因素方差分析(n=3)计算统计显着性。P 值:*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。
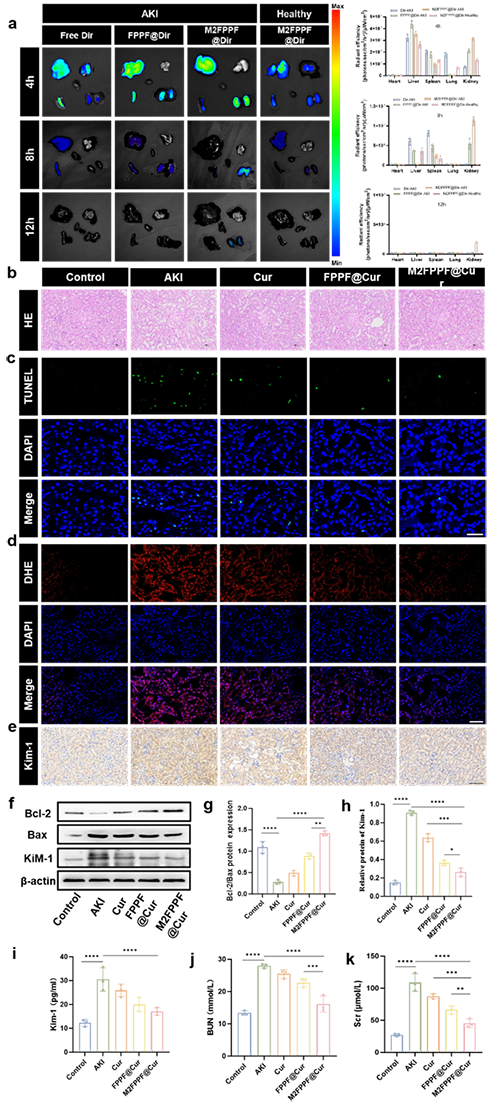
图5.M2FPPF@Cur的体内生物分布和治疗效果。(a)AKI模型中的M2FPPF @ Cur生物分布(b)显示肾切片的代表性H&E染色。比例尺= 100μm。(c)显示用 TUNEL(绿色)和DAPI(蓝色)染色的代表性肾切片的共聚焦图像。比例尺= 100μm。(d)显示用DHA(红色)和DAPI(蓝色)染色的代表性肾切片的共聚焦图像。比例尺= 100μm。(e)显示小鼠肾组织中Kim-1的免疫组织化学染色。比例尺= 50μm。(f)、(g)和(h)目前对小鼠肾组织中Bax、Bcl-2和Kim-1进行蛋白质印迹分析。(i)指示小鼠血清中的Kim-1水平。(j)显示小鼠血清中的BUN水平。(k)显示小鼠血清中的Scr水平。使用单因素方差分析(n = 3)计算统计显著性。P 值:*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001。
原文链接:https://doi.org/10.1016/j.jconrel.2025.01.006
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 哈工大潘昀路教授团队 AFM:从“破乳”入手的肾小球仿生纳米纤维膜 - 实现微纳乳液高通量分离 2026-02-25
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 南方医大沈折玉教授 Biomaterials: 中空介孔三氧化二铁纳米药物介导的瘤内Fe3+/2+循环催化用于大肿瘤铁死亡治疗 2024-11-01
- 南华大学喻翠云/魏华/张海涛团队 JNB:调控组氨酸磷酸酶-铁死亡串扰 - 用于肝细胞癌高效治疗及其机制的研究 2024-10-18
- 王浩/徐万海/乔增莹/孙涛垒《Nat. Commun.》:体内组装增强结合效应增强肿瘤特异性铁死亡治疗 2024-01-16
- 华南理工曹晓东教授、高会场副教授团队 AFM:工程化双重电活性人工神经导管通过调节免疫微环境介导周围神经再生 2024-03-11
