周围神经在人体分布广泛,疾病和意外事故造成的组织损伤往往伴随局部周围神经的缺失或损坏。由于周围神经结构复杂,很难依靠基体实现自我修复,导致缺损神经所控制的感觉和所支配的运动受到影响,显著影响患者生活质量。目前对于长距离周围神经缺损的临床治疗方法主要采用自体神经移植。自体移植是临床的黄金标准,但由于受到供体来源和修复距离的限制,无法完全满足临床需求。近年来人工神经导管已成为治疗长距离周围神经缺损的重要方法,现有神经导管产品因存在缺乏生物活性、无法传递电生理信号等问题,对长距离周围神经缺损修复效果欠佳,难以达到自体移植的修复效果,更多地作为自体移植后的神经保护装置使用。目前研究以及临床实践表明,采用电活性材料构建人工神经导管,赋予人工神经导管导电或自发电的电活性,构建有利于周围神经再生的电生理微环境,是提高人工神经导管修复效果的有效策略。但目前仍然缺乏具有导电性和自发电性一体的人工神经导管,并且电活性材料在周围神经修复领域的应用还面临着起效机制不明确,应用形式受限,无法满足临床实际手术需求等挑战。此外,电活性材料对免疫微环境的调控规律及其促周围神经再生的分子机制尚不清楚。这都极大地限制了电活性人工神经导管在治疗周围神经缺损中的应用。
针对以上问题,华南理工大学曹晓东教授与高会场副教授报道了一种具有导电与压电双重电活性的PVDF/PLCL/PEDOT人工神经导管,该导管具有良好的自发电性能,可以通过促进雪旺细胞的成熟、成髓鞘以及分泌活性因子来促进缺损周围神经的再生。该工作从分子细胞学的角度阐明了电活性材料调节免疫微环境促进周围神经修复再生的可能分子机制:通过上调巨噬细胞的钙离子通道蛋白从而激活PI3K/AKT-Nrf2 抗炎信号通路,最终促进巨噬细胞的募集、M2 极化以及抗炎蛋白分泌,同时通过调节巨噬细胞的旁分泌系统募集雪旺细胞并促进其成熟,进而间接促进周围神经修复。该工作以“Engineered PVDF/PLCL/PEDOT Dual Electroactive Nerve Conduit to Mediate Peripheral Nerve Regeneration by Modulating the Immune Microenvironment”为题发表在国际权威期刊Advanced Functional Materials上(Adv. Funct. Mater. 2024, 2400217),曹晓东教授和高会场副教授为该文的通讯作者,华南理工大学2021级硕士研究生王琪琪为文章第一作者。
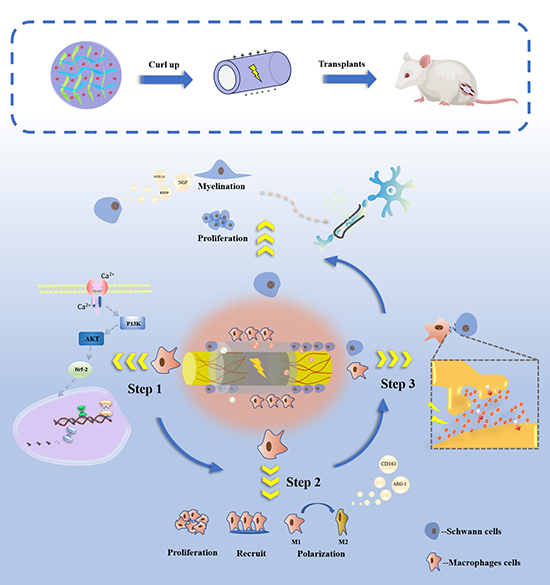
图1 PVDF/PLCL/PEDOT双重电活性人工神经导管通过调节免疫微环境间接促进周围神经修复示意图。

图2. PVDF/PLCL/PEDOT双重电活性复合薄膜的制备与性能表征
以PVDF、PLCL、PEDOT为材料,通过退火结晶以及相分离的制备工艺(图2A)制备了PEDOT纳米粒子分散均匀且具有微孔结构的PVDF/PLCL/PEDOT复合薄膜(图2B)。该复合薄膜具有良好的力学性能(图2C),最大拉伸应力可达15.4MPa,可伸长至681%以上(图2D),能够满足在实际应用中耐缝合以及抗扭结的力学需求。复合膜的电导率达到6.99×10-7S/cm,可促进雪旺细胞髓鞘化(图2E),同时退火结晶的工艺保留了PVDF的β压电结晶相(图2F-G),保证了其复合膜具有压电性能。

图3 PVDF/PLCL/PEDOT双重电活性材料的电学性能及其生物相容性
为了评估材料良好的导电性是否可以在体内传递电信号,将复合膜卷曲成管状,植入大鼠坐骨神经10mm缺损模型中,然后收集复合肌肉动作电位(CMAP),发现电活性神经导管可以在一定程度上传递神经电信号,可植入初期作为“人工神经”替代缺损神经传递电信号(图3B)。同时,当对PVDF/PLCL/PEDOT复合膜施加不同大小的机械力(0.5 N、2 N、4 N),复合膜发出不同电压水平(1.44 V、1.84 V、3.2 V)(图3D),表明电活性复合膜可以将机械能转化为电能,当其在体内接受到肌肉的挤压时可以自发电刺激,从而刺激受损神经再生。此外,PVDF/PLCL/PEDOT复合膜也具有良好的生物活性(图3E-F)。
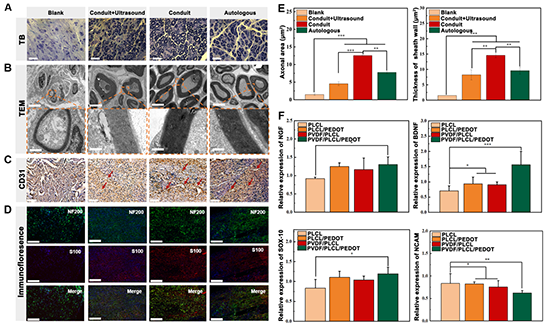
图4. PVDF/PLCL/PEDOT双重电活性材料促进周围神经修复的有效性验证
首先通过体外细胞实验和体内动物实验验证了PVDF/PLCL/PEDOT复合膜对周围神经修复的有效性。结果发现, PVDF/PLCL/PEDOT复合膜可显著上调表达SOX-10、BDNF 和NGF,并下调表达的NCAM基因(图4F),这表明双重电活性复合膜能有效促进雪旺细胞的增殖,成熟、成髓鞘。进一步将其卷曲成管,植入大鼠坐骨神经10mm缺损模型中,评价其坐骨神经修复效果。结果表明,电活性神经导管可以显著促进髓鞘形成和轴突伸长,并促进再生神经中新生血管成熟,修复效果与自体移植组相近(图4A-E)。
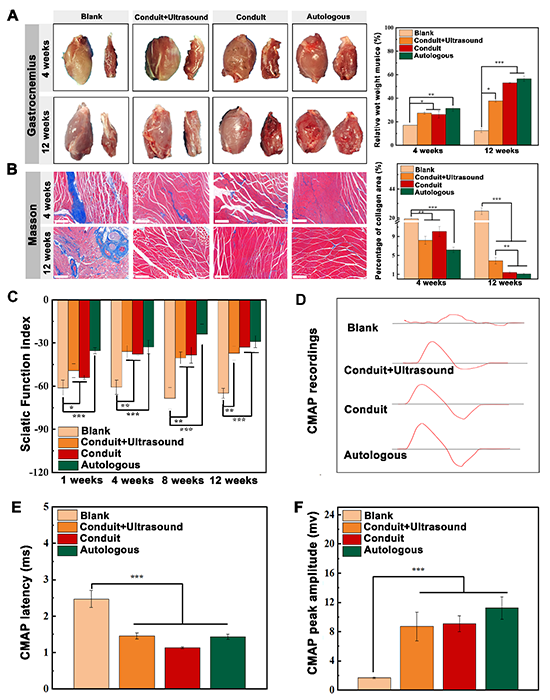
图5.PVDF/PLCL/PEDOT双重电活性神经导管促进缺损坐骨神经信号传导功能恢复及其支配的运动功能重建
本研究进一步通过Masson染色、SFI运动功能指数以及CMAP肌肉动作电位测定评估PVDF/PLCL/PEDOT电活性神经导管促进缺损坐骨神经信号传导功能恢复及其支配的运动功能重建的效果。结果显示,导管组可以抑制受损神经所支配腓肠肌的萎缩,减少胶原沉积(图5 A-B),所有实验组在第1周时都已与空白对照组的SFI指数出现显著差异,并且随着时间的推移,显著差异越来越大(图5C)。CMAP的结果表明,导管组传导电信号的功能与自体移植组相似(图5D-F)。这些结果表明,电活性神经导管在促进受损周围神经再生方面具有优越的功效,其修复效果甚至可以与自体神经移植物相媲美。值得一提的是,导管+超声组在各个维度上修复效果都次于导管组,这是由于超声形成的热效应和空化效应对组织修复产生不利影响。
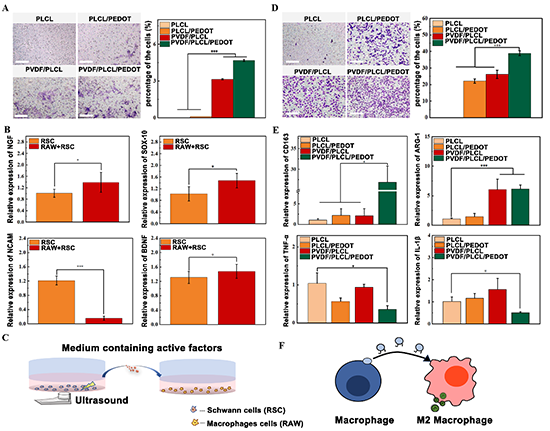
图6. 双重电活性材料通过介导巨噬细胞行为影响雪旺细胞
众所周知,当组织损伤发生时,免疫系统的反应对组织修复至关重要。本研究通过巨噬细胞与雪旺细胞共培养实验,探究了在电活性材料的介导下,巨噬细胞对雪旺细胞的影响。结果表明,电活性复合薄膜可以通过影响巨噬细胞的旁分泌系统对雪旺细胞产生良好的募集效果(图6A),并且可以显著促进雪旺细胞成熟、成髓鞘和分泌神经营养因子(图6B-C)。进一步探索双重电活性复合薄膜对巨噬细胞的具体作用。结果发现,电活性材料具有募集巨噬细胞的能力,并且导电和压电性具有协同促进巨噬细胞募集的效果(图6D)。此外,其还有效地上调了抗炎因子(ARG-1、CD163)的表达,而下调了促炎因子(TNF-α,IL-1β)的表达(图6E)。然而PLCL/PEDOT导电薄膜与PVDF/PLCL压电薄膜并没有显示同样的效果,说明导电性和压电性在发挥抗炎效果的层面具有显著的协同作用。这些结果表明双重电活性材料具有调节巨噬细胞向 M2 抗炎表型的转变的能力(图6F)。

图7. 双重电活性复合薄膜激活了PI3K/AKT-Nrf2信号通路达到抗炎效果。
为了进一步确定电活性材料具有抗炎作用的分子机制,本研究通过RT-qPCR实验,WB实验以及免疫荧光染色实验对可能的信号机制进行筛选 (图7)。研究发现,电活性材料可以上调PI3K,AKT以及Nrf-2的基因表达,并上调p-PI3K、p-AKT蛋白表达水平。并通过免疫荧光染色发现PVDF/PLCL/PEDOT组中核转录因子Nrf2发生了核转移。初步判定PVDF/PLCL/PEDOT双重电活性复合膜具有通过促进PI3K和AKT的磷酸化,进而促进Nrf-2的核转移来达到调控炎症环境,上调抗炎蛋白表达而抑制促炎蛋白表达的效果。为了进一步验证这一论点,在巨噬细胞培养过程中添加PI3K抑制剂LY294002,抑制PI3/AKT信号通路的激活,发现添加抑制剂后所有组别的PI3K均无上调,且其下游抗炎蛋白CD163和ARG-1的也未被上调,因此反向验证了电活性复合膜确是通过激活PI3K/AKT信号通路调节炎症环境。

图8. 体内动物实验证明PVDF/PLCL/PEDOT双重电活性导管通过激活PI3K/AKT信号通路调节免疫微环境
为了进一步确认电活性材料在复杂的体内环境中仍然具有同样的抗炎效果,本研究将PVDF/PLCL/PEDOT复合膜卷曲成神经导管移入到大鼠坐骨神经10mm缺损模型中,分别在第1周和第4周将在受损神经组织的远端、近端以及再生部分解剖离体,采用RT-qPCR检测信号通路中关键基因(PI3K、AKT、HO-1)的表达。同时,对M1巨噬细胞标志蛋白CD86以及M2巨噬细胞标志蛋白CD206进行免疫荧光染色,表征在电活性神经导管介导下损伤部位的炎症环境。结果表明,在电活性神经导管的介导下,PI3K、AKT和HO-1均显著上调(图8A),且CD206与CD86的免疫荧光染色结果与RT-qPCR的结果保持一致,表明电活性神经导管在体内仍然具有促进巨噬细胞向M2抗炎表型极化的效果(图8C)。同时,为了反向验证信号通路的准确性,在动物实验中,设置了LY294002+导管组,对该组别的大鼠进行隔日腹腔注射PI3K抑制剂LY294002的处理,持续一月。发现该组别显示出了较为显著的炎症反应,与纯导管组的结果相反,进一步确定了双重电活性神经导管是通过激活PI3K/AKT信号通路达到的抗炎效果(图8B)。
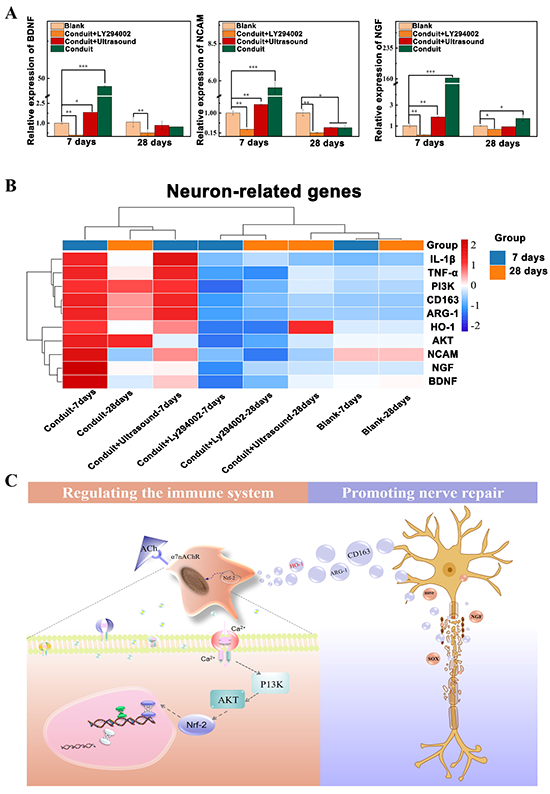
图9. 双重电活性神经导管通过调节免疫微环境间接促进周围神经修复
体外细胞实验已经证明了在电活性材介导下巨噬细胞会分泌相关活性因子,从而影响雪旺细胞,间接促进周围神经修复,本研究在体内动物实验也进一步论证了这一论点。采用RT-qPCR实验检测与神经修复相关蛋白(NGF、BDNF、NCAM)的表达,结果表明其表达与抗炎相关蛋白的表达趋势相同,并且在具有PI3K抑制剂LY294002的组别中,NGF、BDNF的表达显著下降且NCAM升高(图9A)。为了更加直观和全面的分析本研究中所有RT-qPCR基因检测结果,将所有组别在两个时间节点(第1周,第4周)上涉及到的所有基因表达水平进行了聚类热图分析(图9B)。导管组组不管是在哪个时间节点,都能激活PI3K/AKT信号通路,促进HO-1的表达来调节炎症环境,并上调抗炎因子的表达而抑制促炎因子的表达,最终促进周围神经修复。
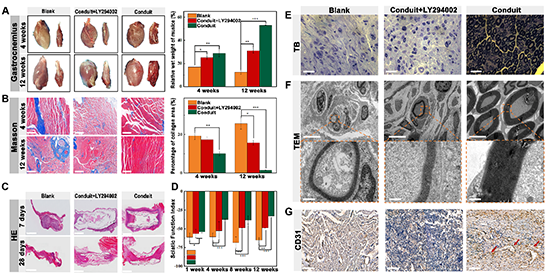
图10. 电活性材料对免疫微环境的调节对受损坐骨神经的修复具有重要意义
为了验证炎症信号通路的阻断是否最终会影响其运动功能的恢复,在动物实验中,本工作还设置了导管+LY294002组。结果显示,不同组对腓肠肌萎缩的抑制程度如下:空白组<导管+LY294002组<导管组(图10A-B),表明虽然电活性神经导管可显著抑制腓肠肌萎缩,但当炎症信号通路被阻断时,电活性神经导管对腓肠肌的抑制作用大大减弱。此外,还对再生神经的纵切面进行了H&E染色(图10C),发现导管组在第28天实现了横断神经的完全连接,而导管+LY294002组尚未实现损伤神经的远端与近端连接。SFI运动功能指数的测试结果(图10D),甲苯胺蓝染色(图10E)和透射电镜观察再生神经的轴突形成和髓鞘再生结果(图10F)以及CD31免疫组化染色结果(图10G)都显示导管组具有较好的促坐骨神经再生的作用。然而,当PI3K/AKT-Nrf2信号通路被阻断时,其修复效果大打折扣,并且随着时间的延长,这种现象变得更加突出。从上述结果不难得出,免疫微环境的调节对周围神经的修复至关重要,当免疫微环境调控途径被阻断时,其促进神经修复的作用大大减弱。
本研究证明了电活性材料在调节免疫微环境和周围神经修复中的有效性,同时突出了免疫调节在周围神经修复中的关键作用,为电活性人工神经导管应用于临床周围神经修复提供了理论依据。
该研究工作得到了国家自然科学基金(31971261、52272276、52073103)、广东省基础与应用基础研究基金(2023A1515012232、2020A1515010668)等经费资助。
原文链接:https://doi.org/10.1002/adfm.202400217










