放疗是治疗原发性或转移性脑瘤的重要手段,但同时它也可能对正常脑组织造成损害,引起放射性脑损伤(radiation-induced brain injury,RIBI),这可能导致认知功能障碍、头痛、倦怠等症状。这种认知功能障碍通常表现为注意力、记忆力、执行能力和决策能力的下降,严重影响患者的生活质量。
目前,放射性脑损伤的发病机制尚未完全明确,但已知辐射可以导致脑内氧化应激增加、炎症反应、微血管损伤以及血脑屏障(BBB)破坏等。这些变化可能在放疗后立即发生,也可能在数月或数年后逐渐显现。因此,开发有效的预防和治疗策略对于改善患者预后至关重要。
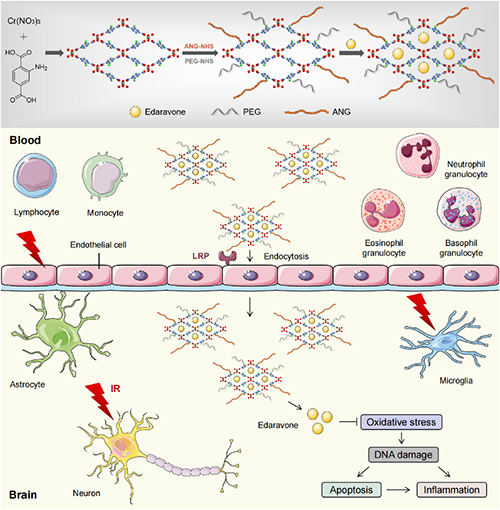
图1. 金属有机框架-纳米复合物用于治疗放疗引起的脑损伤
本项目开发了一种能够通过血脑屏障(BBB)并持续释放神经保护药物的载体,以减轻放疗引起的脑损伤。首先合成了MIL-53(Cr)纳米粒子,并通过表面修饰聚乙烯乙二醇(PEG)和Angiopep-2(ANG)来提高其口服生物利用度和穿越BBB的能力。将依达拉奉(edaravone,一种自由基清除剂,具有神经保护作用,它通过清除羟基自由基和抑制脂质过氧化来保护脑组织)载入修饰后的MIL-53(Cr)纳米粒子中,形成EDA@MIL-53(Cr)-P/A纳米粒子。MIL-53(Cr)-P/A纳米粒子能够实现依达拉奉的持续释放,并提高其穿越BBB的能力。在小鼠模型中,EDA@MIL-53(Cr)-P/A能够减轻全脑照射引起的脑损伤和认知功能障碍。机制研究表明,EDA@MIL-53(Cr)-P/A通过抑制氧化应激、DNA损伤、凋亡和炎症反应来减轻辐射引起的脑损伤。总之,该方法为保护免受放疗引起的脑损伤提供了一种新策略,对改善接受颅脑放疗患者的生活质量具有重要价值。
论文第一作者为西湖大学医学院附属杭州市第一人民医院李雪娇博士,浙江大学博士生华诗远;浙江大学爱丁堡大学联合学院周民教授和与西湖大学医学院附属杭州市第一人民医院丁忠祥教授合作为该论文的共同通讯作者。上述研究得到了国家重点研发计划项目、国家自然科学基金、浙江省重点研发计划项目等基金项目的大力支持。
论文链接:https://doi.org/10.1016/j.biomaterials.2024.122868
课题组简介
浙江大学周民教授:浙江大学求是特聘教授; 教育部恶性肿瘤预警与干预重点实验室副主任,国家高层次领军人才,国家高层次人才专家。主要从事医学影像学与生物材料临床转化工作。近年来发表100余篇论文,多次荣获“浙江大学十大年度学术进展提名奖”。科研成果多次被新华社,科技日报等新闻媒体做专题报道。自主研发纳米药物正在开展临床试验,临床结果疗效显著。团队研发新型微藻药物递送系统受到科研及社会各界广泛关注。课题组主页:https://person.zju.edu.cn/mi
- 哈工大邵路教授团队 JACS:聚合物编织金属有机框架玻璃膜家族用于超强耐压碳捕集 2026-01-07
- 吉大杨英威教授、秦建春教授团队 JCR:金属有机框架双功能纳米系统用于缓解酸铝胁迫并调节植物生长 2024-11-19
- 英属哥伦比亚大学 Zachary Hudson教授等 JACS:导向网状化学合成介孔ZIFs 2024-11-02
- 喻翠云/魏华团队 ACS Nano:基于二甲双胍的多功能纳米平台作为DNA损伤放大器 - 用于最大化放射免疫治疗以克服放疗耐药 2025-04-14
- 华科大罗亮/同济医院刘博联合团队 ACS Nano:碳碘共轭高分子CT影像引导放疗增敏 2024-03-14
- 澳门大学代云路 Adv. Mater.:双重表观遗传学治疗逆转放疗后的免疫耐受与抑制 2024-02-21
- 山东大学 Nat. Mater.:超声响应压电纳米贴片调控神经干细胞分化治疗创伤性脑损伤 2025-05-09
