神经退行性疾病的特征是神经元结构和功能的逐步丧失,导致认知障碍、神经元死亡和神经胶质细胞活动失衡。帕金森疾病(PD)是第二常见的主要中枢神经退行性疾病,尤其常见于老年人,其有效治疗仍然是人们关注的焦点。PD通常以黑质和纹状体多巴胺能神经元的缺失和细胞内α-突触核蛋白(α-syn)的聚集为特征,其中涉及多种途径和机制包括氧化应激、神经炎症、线粒体功能障碍、路易体的形成等。目前PD的治疗主要依赖于调节多巴胺水平的药物、抗胆碱药和谷氨酸拮抗剂。神经核破坏和深部脑刺激等手术干预也作为替代方案。然而,化学疗法常受血脑屏障和缺乏靶向给药系统的限制,手术操作也存在引发炎症和潜在脑损伤的风险。
血脑屏障(BBB)是大脑中动态且高度选择性的实体屏障,可以保护大脑免受循环血液中有毒物质的影响,维持其稳定性。然而,BBB的保护性能同样也给治疗大脑疾病的传统药物带来了重大挑战,由于BBB的存在,几乎所有的大分子和98%的小分子进入大脑受到阻挡。因此,开发能够穿透BBB并针对大脑病变部位给药的递送系统对于有效治疗神经退行性疾病至关重要。
在PD的发展过程中,BBB的完整性会受到损害。表面羟基密集的聚乙二醇修饰的聚酰胺-胺(PAMAM)树状大分子被证明能够穿过受损的BBB,同时靶向调节小胶质细胞和受炎症影响的区域,发挥抗炎和抗氧化治疗作用。含磷树状大分子不仅具有高度分支、对称的结构和均一的分子量,由于含有的磷元素而具有独特的生物学特性,显示出作为递送载体的潜力。在早期的研究中,不同代数的含磷树状大分子已被验证可有效抑制α-syn原纤维的形成,因而具有作为α-syn聚集抑制剂的潜力。
纤连蛋白(FN)是一种由两个亚基通过二硫键连接而成的蛋白质,广泛存在于各种组织、细胞外基质、体液和血液中,具有多种生物学功能。FN分子骨架上含有精氨酸-甘氨酸-天冬氨酸(RGD)序列,因而具有良好的炎症靶向效果。前期工作表明,结合纳米技术对FN的胞内递送可通过促进巨噬细胞M2型极化以及清除活性氧充分发挥FN的抗炎和抗氧化作用(Biomacromolecules 2023, 24, 886-895;ACS Nano 2024, 18, 2195-2209; ACS Nano 2024, 18, 10625–10641)。因此,假定通过结合具有末端羟基的低代含磷树状大分子和FN,有望渗透受损血脑屏障并充分发挥两者的生物学活性,从而增强PD的治疗。

图1. 制备AK123/FN NCs用于联合治疗帕金森病的示意图。通过诱导M2型小胶质细胞极化、缓解氧化应激、抑制炎症反应以及抑制α-syn聚集来实现联合治疗。

图2.(A)FN和不同质量比下AK123/FN NCs的水动力学尺寸、(B)zeta电势和(C)PDI。(D)AK123/FN NCs在AK123/FN质量比为4时的TEM图像和(E)尺寸分布直方图。(F)BV2细胞经不同浓度AK123或AK123/FN处理24 h后的细胞活力。(G)流式细胞术直方图和(H)BV2细胞经PBS、FN或AK123/FN NCs处理12 h后的荧光强度定量。(I)预先处理不同抑制剂后BV2细胞对AK123/FN NCs的细胞摄取途径评估。

图3.(A)流式细胞术分析AK123、FN、AK123/FN或AK123/BSA处理的LPS激活的BV2细胞中CD86和CD206的表达水平。BV2细胞中(B)CD86和(C)CD206表达的平均荧光强度。(D)CD206/CD86比值。(E)不同材料孵育24 h后BV2细胞内ROS的CLSM图像。不同材料处理后LPS激活的BV2细胞中(F)IL-6、(G)IL-1β和(H)TNF-α表达的ELISA分析。

图4.(A)在尾静脉注射不同材料后0.5、1、2、4和6 h对活小鼠进行荧光成像。(B)AK123/FN-Cy5.5 NCs或(C)FN-Cy5.5注射后6 h小鼠主要器官和大脑的离体荧光成像。(D)分别在注射FN-Cy5.5和AK123/FN-Cy5.5 NCs后6 h小鼠主要器官和大脑的平均荧光强度。通过荧光成像测定注射后6 h、12 h,3天和5天(E)主要器官和(F)脑中AK123/FN NCs的生物分布。
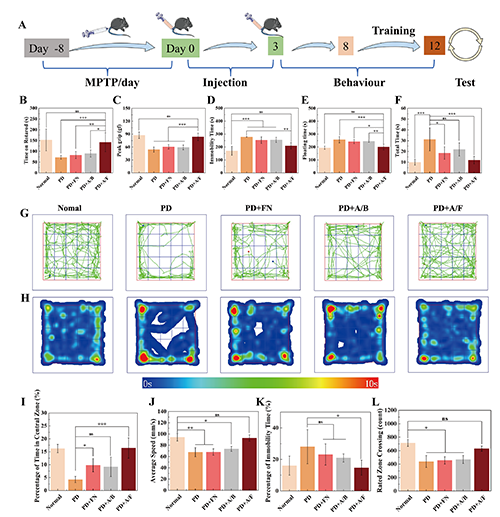
图5.(A)PD小鼠的治疗和测试时间表的示意图。(B)旋转棒疲劳仪测试中小鼠在旋转棒的时间,(C)握力测试中的峰值握力,(D)悬尾测试中的不动时间,(E)强迫游泳测试中的漂浮时间和(F)爬杆测试中的总时间。(G)旷场实验中不同组的小鼠的代表性路径和(H)时间热图,(I)中心区的时间百分比,(J)平均速度,(K)不动时间百分比以及(L)额定区域交叉。

图6.(A)脑和海马CA1区H&E染色图像和神经元Nissl染色。(B)不同组小鼠纹状体GFAP和α-syn的免疫荧光染色和(C)α-syn的相对荧光强度。(D)CD206+/CD86+相对荧光强度比值。(E)TH的相对荧光强度和(F)不同组小鼠大脑中多巴胺的相对水平。
简而言之,研究团队所制备的AK123/FN NCs具有以下优势:1)易制备且在水溶液中相当稳定,分散性良好,FN络合可有效提高AK123的水分散性;2)AK123/FN NCs由于树状大分子末端的羟基可以穿过受损BBB的能力,并能通过FN的RGD序列靶向表达整合素的小胶质细胞,将FN和AK123靶向递送至脑PD病变部位;3)AK123/FN NCs可通过联合的抗炎和抗氧化作用,促进小胶质细胞从M1向M2表型的极化,抑制NF-κB信号通路以减少炎症因子表达,抑制α-syn的聚集,从而发挥协同治疗PD的作用。该团队的研究为PD治疗提供了一种全新的方向,这可能治疗其他神经退行性疾病中得到应用。
文章链接:https://doi.org/10.1016/j.bioactmat.2024.04.005
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学沈明武/史向阳团队《Acta Biomater.》:含磷树状大分子介导的生物矿化用于协同的肿瘤阻断治疗与乏氧激活化疗 2025-04-28
- 东华大学史向阳教授团队 Nano Today:基于含磷树状大分子的药物递送系统协同增强自噬、抗炎和抗氧化治疗阿尔茨海默症 2025-02-11
- 山东大学崔基炜/王连雷教授《ACS Nano》:骨“创可贴”用于骨质疏松性骨折修复 2025-12-07
- 浙大周民教授团队 Bioact. Mater.:微藻药物递送系统"降尿酸-抗炎-消化系统保护"三位一体协同用于痛风性关节炎的治疗 2025-06-04
- 西南医大口腔医院陶刚/黎春晖/蔡蕊团队:具有ROS触发药物释放特性的可注射水凝胶实现抗菌剂和抗炎纳米颗粒协同递送用于牙周炎治疗 2025-04-15
- 华东理工刘润辉教授与合作者《Bioact. Mater.》:易于制备的抗氧化和抗菌水凝胶薄膜 → 快速止血和促进感染性糖尿病创面愈合 2025-07-31
