阿尔茨海默病(AD)是最常见的神经退行性疾病之一,其特点是神经元逐渐退化,导致认知能力逐渐下降。随着病情的发展,患者可能完全丧失生活自理能力,难以适应周围环境。AD的发病机制错综复杂,包括β-淀粉样蛋白(Aβ)的异常聚集、激活的小胶质细胞引发氧化应激和神经炎症、神经元功能障碍等,加上血脑屏障(BBB)带来的巨大挑战,极大地阻碍了治疗药物向病灶区域的有效输送。目前的单药疗法只能针对AD发展过程中的特定方面,而在解决整个病理途径的疗效有限。寻求全面调节脑部炎症微环境以有效改善AD病理的治疗策略至关重要。
自噬被广泛认为是一种自我保护机制,它能使细胞承受各种环境压力,如营养或生长因子匮乏、缺氧、活性氧(ROS)或DNA损伤。加强细胞自噬以加速Aβ聚集体的分解和代谢被认为是一种很有前景的治疗策略,尤其是在神经退行性疾病中。雷帕霉素(Rap)可通过调节小胶质细胞活性和减少促炎介质的分泌,因而具有抗神经炎和神经保护特性。此外,Rap通过抑制mTOR活性促进自噬体形成,促使自噬体与溶酶体融合,形成自噬溶酶体,可有效清除神经元细胞中受损或异常积累的蛋白质,如Aβ和α-突触核蛋白。
纳米平台的开发为有效治疗AD提供了新途径。其中,羟基封端的含磷树状大分子不仅可以作为纳米载体有效穿透BBB,实现大脑的靶向给药,而且还表现出独特的生物特性,如抗炎和免疫调节活性。这些树状大分子在发挥内在生物活性的同时,还能抑制异常蛋白质聚集,因而在治疗神经退行性疾病方面具有双重潜力。与此同时,纤连蛋白(FN)通过抑制核因子卡巴-B(NF-κB)信号通路、减少促炎因子的表达以及促进巨噬细胞向M2表型转化,表现出显著的抗炎和抗氧化特性。FN在治疗神经退行性疾病方面大有可为,特别是由于其Arg-Gly-Asp(RGD)序列可促进其靶向小胶质细胞表面整合素,增强其调节神经炎症和氧化应激的能力。在近期的工作中,团队构建了亚磷酸钠或羟基封端的含磷树状大分子/FN纳米药物,通过结合树状大分子自身的抗炎活性以及FN的抗炎抗氧化活性协同缓解巨噬细胞或小胶质细胞内氧化应激,促进M2分型,降低炎症反应,成功用于急性肺损伤/痛风、缺血性脑卒中和帕金森病的抗炎/抗氧化治疗(ACS Nano 2024, 18, 2195-2209; Adv. Healthcare Mater. 2024, 13, 2401462; Bioact. Mater. 2024, 38, 45-54)。
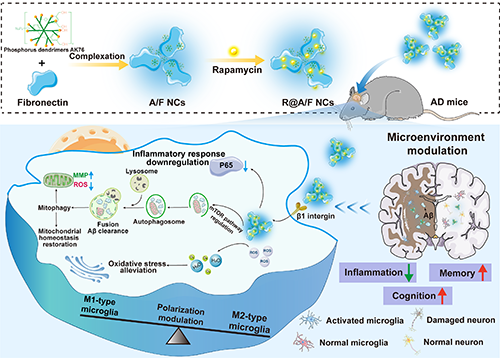
图1. R@A/F NCs的合成及其用于AD的联合治疗示意图。
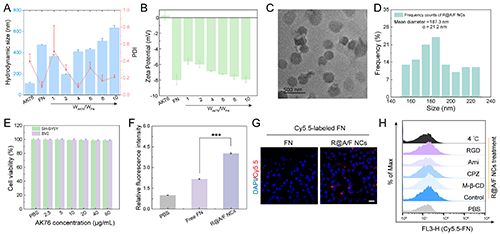
图2. (A)不同AK76/FN质量比(1、2、4、6、8或10)下AK76、游离FN或A/F NCs的水动力学直径和PDI以及(B)zeta电位。(C)AK76/FN质量比为2时R@A/F NCs的TEM图像和(D)尺寸分布直方图。(E)SH-SY5Y和BV2细胞经不同浓度AK76的R@A/F处理后的活力。(F)用PBS、游离FN-Cy5.5或A/F-Cy5.5 NCs处理BV2细胞后的相对荧光强度。(G)CLSM观察用FN-Cy5.5或R@A/F-Cy5.5 NCs培养8小时后BV2细胞内的荧光。(H)用多种抑制剂预处理后再用R@A/F-Cy5.5 NCs培养2小时的BV2细胞的流式细胞术直方图。
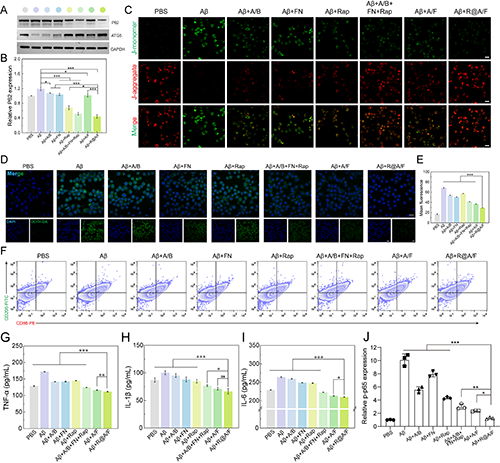
图3.(A)WB检测分析不同处理后Aβ处理的BV2细胞中P62和ATG5的蛋白表达水平。(B)P62蛋白相对表达量的定量分析。(C)CLSM检测不同材料处理的Aβ挑战的BV2细胞中MMP变化。(D)CLSM观察不同处理后Aβ挑战的BV2细胞中ROS的表达。(E)不同处理后Aβ挑战的BV2细胞中ROS表达的平均荧光强度。(F)通过流式细胞术评估不同处理后Aβ挑战的BV2细胞中CD86和CD206的表达水平。ELISA分析BV2细胞中(G)TNF-α、(H)IL-1β和(I)IL-6的分泌水平。(J)通过CLSM观察分析不同处理后Aβ挑战的BV2细胞中p-p65的相对表达水平。


图5. (A)AD小鼠的治疗和测试安排。(B)不同组别AD小鼠在NOR测试中的代表路径。(C)根据(B)计算的识别指数量化。(D)不同组别小鼠在MWM测试中的游泳轨迹。红点表示起点,黑点表示终点。(E)不同组小鼠在目标象限内的时间、(F)逃逸潜伏期和(G)穿越平台的次数。
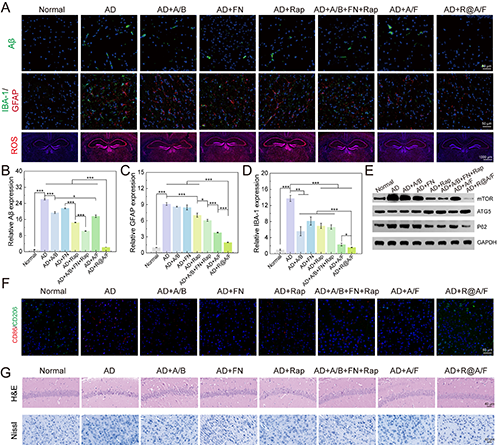
图6.(A)不同组小鼠脑部Aβ、IBA-1/GFAP和ROS的免疫荧光图像。(B)Aβ、(C)GFAP和(D)IBA-1在不同组中的相对表达量。(E)mTOR、ATG5和P62的WB表达分析。(F)不同处理后小鼠脑部CD86/CD206的免疫荧光染色。(G)不同组海马区的H&E染色和神经元的Nissl染色。
简而言之,该研究设计的纳米药物具有以下优势:(1)以含磷树状大分子为基础的递送系统显著提高了FN和Rap的生物利用度,同时末端羟基赋予NCs穿透受损BBB的能力,通过FN介导靶向过表达α4β1整合素的小胶质细胞,促进纳米药物靶向递送至AD病变部位;(2)R@A/F NCs可协同AK76、FN和Rap的抗炎和抗氧化作用,促进氧化应激缓解、线粒体功能恢复、自噬增强和诱导小胶质细胞M2极化,从而协同抑制Aβ的聚集并改善AD认知缺陷。所开发的纳米药物结合了生物活性含磷树状大分子和多组分药物治疗AD的优势,有望用于不同神经退行性疾病的免疫调节治疗。
文章链接:https://doi.org/10.1016/j.nantod.2025.102664
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学沈明武/史向阳团队《Acta Biomater.》:含磷树状大分子介导的生物矿化用于协同的肿瘤阻断治疗与乏氧激活化疗 2025-04-28
- 东华大学沈明武/史向阳Biomaterials:具有生物活性的含磷树状大分子共递送蛋白质/药物用于巨噬细胞重编程增强骨关节炎治疗 2024-12-09
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 川大张兴栋院士团队王启光/樊渝江:自润滑杂化外泌体微凝胶通过体内靶向Foxo3基因编辑调控软骨细胞线粒体自噬以缓解骨关节炎进展 2025-01-24
