骨转移是肺癌、前列腺癌和乳腺癌等多种晚期恶性肿瘤患者常见并发症之一。近年来,铁死亡疗法为抗肿瘤治疗提供了一种新的策略。然而,受限于铁死亡诱导剂不可控的全身分布以及骨组织独特的生理环境,铁死亡诱导剂往往难以实现向骨转移瘤部位的有效递送。另外,肿瘤微环境中丰富的抗氧化剂(如谷胱甘肽)以及不充足的过氧化氢(H2O2),进一步限制了铁死亡治疗的效率。因此开发可激活纳米体系,通过外源信号控制药物的按需释放以及对肿瘤微环境的重编程,以实现精确且增强的铁死亡疗效至关重要。

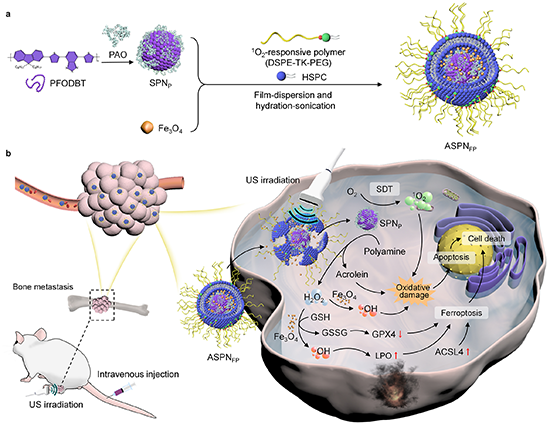
图1. ASPNFP的合成路线及抗肿瘤机制示意图
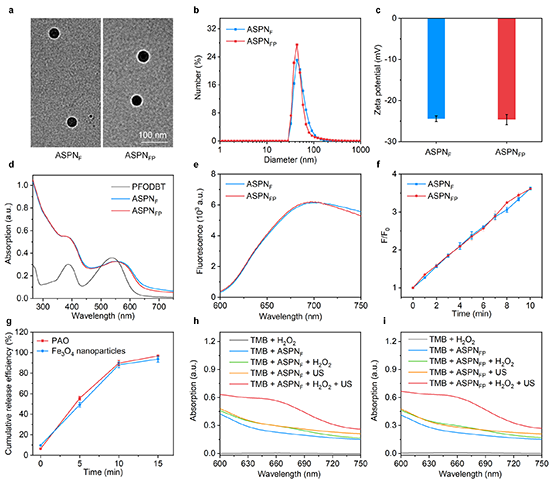
图2. ASPNFP及其对照组的体外表征
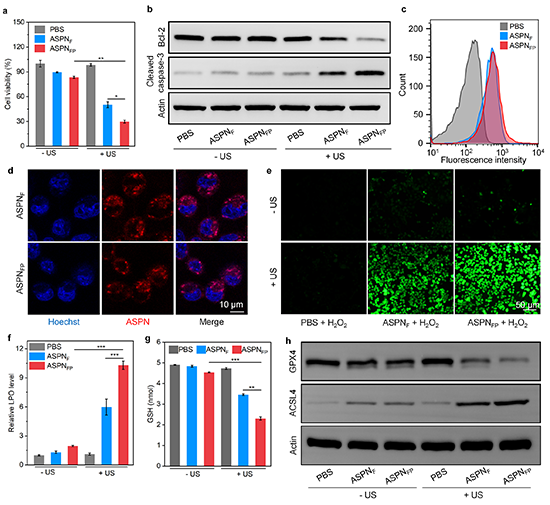
图3. 体外ASPNFP治疗效果和作用机制的评价
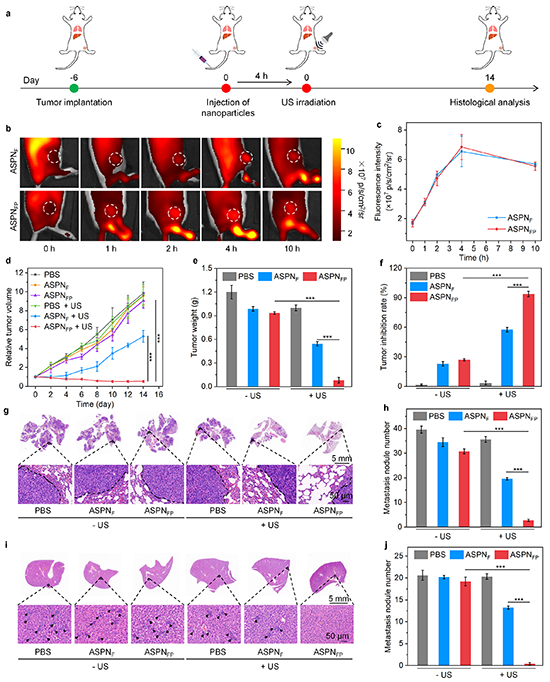
图4. 体内肿瘤富集、治疗效果及抗转移效果的评价
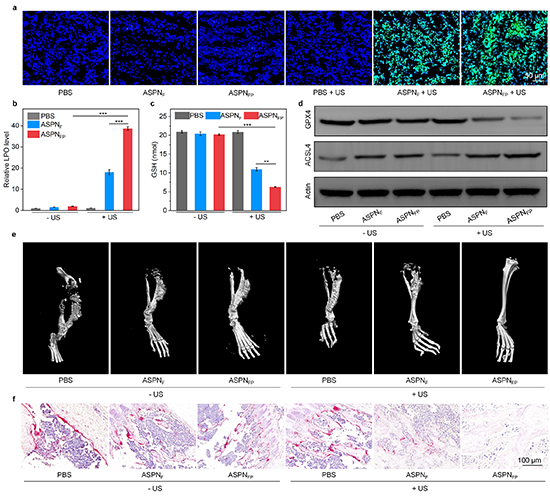
图5. 体内治疗机制以及骨转移相关骨损伤的评价
总之,该纳米诱导剂在骨转移瘤的治疗中具有显著优势:(i)ASPNFP可以聚集在骨转移瘤部位,在局部US照射下产生1O2,从而实现SDT效应并破坏纳米系统的结构来释放PAO和氧化铁纳米颗粒;(ii)肿瘤微环境中的聚胺被PAO分解产生丙烯醛和H2O2,后者可以与瘤内H2O2一起被氧化铁纳米颗粒利用,来介导Fenton反应以实现增强型铁死亡;(iii)SDT、Fenton反应以及聚胺被分解的过程中产生的1O2、·OH和丙烯醛联合放大了肿瘤的氧化损伤。
文章信息:Yijing Zhang, Qin Zhang, Fengshuo Wang, Meng Li, Xiangyang Shi*, Jingchao Li*, Activatable Semiconducting Polymer Nanoinducers Amplify Oxidative Damage via Sono-Ferroptosis for Synergistic Therapy of Bone Metastasis, Nano Letters, 2023.https://doi.org/10.1021/acs.nanolett.3c02414
- 东华大学李静超 Angew:半导体聚合物纳米反应器通过超声触发级联乳酸消耗用于胰腺癌铜死亡-免疫治疗 2024-05-07
- 东华大学李静超 Angew:双靶向仿生半导体聚合物纳米复合物用于骨转移瘤增强型诊疗 2023-11-29
- 湘潭大学陈盛团队《Adv. Funct. Mater.》:基于P型半导体聚合物填料构建物理交联和电子-空穴对提升高温储能 2023-11-14
- 西南大学许志刚/武汉大学孙志军 Nano Today:内/外源调控肿瘤细胞焦亡的聚合物纳米诱导剂用于增效肿瘤免疫治疗 2023-01-11
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
