东华大学李静超 Angew:半导体聚合物纳米反应器通过超声触发级联乳酸消耗用于胰腺癌铜死亡-免疫治疗
2024-05-07 来源:高分子科技
肿瘤微环境中高水平乳酸不仅促进肿瘤的发展和转移,而且诱导免疫逃逸,导致各种肿瘤治疗策略的失败。乳酸代谢干扰策略可以用于癌症治疗,但乳酸代谢的随机紊乱也会引起严重毒副作用,因此乳酸氧化酶(LOx)的控制给药有望实现有效、安全的癌症治疗。尽管乳酸消耗为癌症治疗提供了一个新方案,但往往需要通过与其他治疗方法联合以提高疗效。铜死亡是一种由铜超载引起的非凋亡细胞死亡模式,因此铜死亡和乳酸消耗的联合有望为癌症治疗提供新策略。

基于以上背景,东华大学李静超团队报道了一种基于半导体聚合物纳米反应器(SPNLCu)通过超声触发级联乳酸消耗策略实现铜死亡-免疫治疗(图1)。SPNLCu主要含有半导体聚合物作为声敏剂、通过活性氧(ROS)可切割片段偶联的乳酸氧化酶(LOx)和Cu2+螯合物。在超声刺激下,半导体聚合物产生单线态氧(1O2)切割ROS可切割片段,导致LOx释放,从而催化乳酸消耗产生过氧化氢(H2O2)。Cu2+在肿瘤微环境中被还原为Cu+,与生成的H2O2反应生成羟基自由基(·OH),通过破坏ROS可切割片段进一步促进LOx释放。因此,超声触发LOx级联释放可实现乳酸的有效消耗,从而减轻了乳酸的免疫抑制作用。此外,铜死亡引起免疫原性细胞死亡(Immunogenic Cell Death, ICD),从而激活抗肿瘤免疫效应。

图1. SPNLCu的合成路线及抗肿瘤机制示意图

图2. SPNLCu及对照材料的性能表征
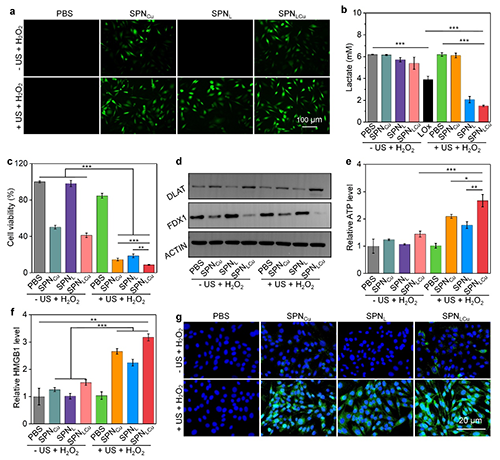
图3. SPNLCu体外治疗效果、铜死亡及ICD性能表征
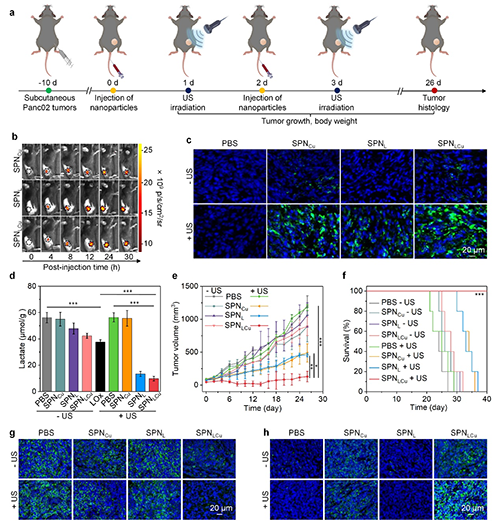
图4. Panc02荷瘤小鼠皮下模型的体内抗肿瘤效应评估
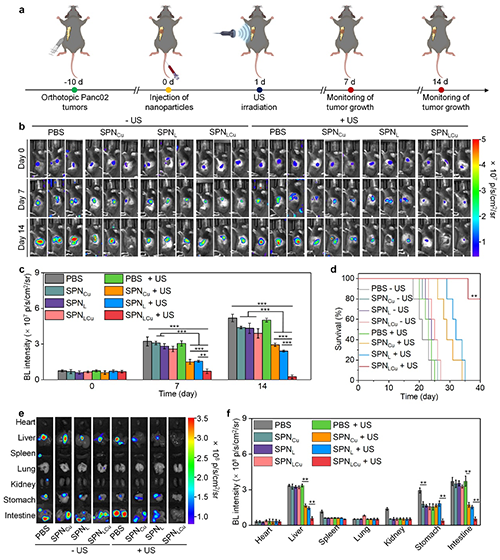
图5. 深层原位胰腺Panc02肿瘤小鼠模型的体内抗肿瘤效应

图6. 深层原位胰腺KPC肿瘤模型的体内抗肿瘤效应
综上所述,该团队构建的半导体聚合物纳米反应器(SPNLCu)可以为癌症治疗提供一种精确有效的乳酸消耗策略。超声触发的级联乳酸耗竭可以增强SDT和铜死亡引起的ICD效应。值得注意的是,基于SPNLCu的治疗可以显著抑制皮下胰腺肿瘤生长并限制深层原位胰腺Panc02和KPC肿瘤模型的肿瘤发展和转移。这项研究首次报道了超声触发的级联乳酸消耗策略用于肿瘤治疗,在癌症治疗方面展示出巨大的前景。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202405639
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 东华大学李静超 Angew:双靶向仿生半导体聚合物纳米复合物用于骨转移瘤增强型诊疗 2023-11-29
- 湘潭大学陈盛团队《Adv. Funct. Mater.》:基于P型半导体聚合物填料构建物理交联和电子-空穴对提升高温储能 2023-11-14
- 东华大学李静超《Adv. Sci.》:声激活半导体聚合物纳米整形器多重重塑肿瘤微环境用于原位胰腺癌有效免疫治疗 2023-10-29
- 江苏科技大学郭峰/施伟龙课题组 CEJ:一步式无模板热聚合制备CDs/g-C3N4纳米反应器实现高效光热辅助-光催化产氢 2024-04-15
- 江苏科技大学郭峰/施伟龙 ASS:构筑S型异质结催化纳米反应器以促进光热辅助光催化制氢 2023-10-17
- 国科温州研究院刘勇研究员《Adv. Mater.》:超分子光热级联纳米反应器用于促进生物被膜感染的拔牙伤口愈合 2023-06-08
- 苏大陈倩教授团队《Mater. Today》:超声触发原位自组装药物水凝胶 - 为肝动脉灌注化疗带来新范式 2025-12-20
