南京大学甄叙、蒋锡群团队《Adv. Mater.》: 超声驱动STING通路激活用于精准声免疫治疗研究
免疫治疗为癌症治疗提供了新的机遇,然而免疫治疗应答率低以及易引起免疫相关不良反应(Immune related adverse events, irAEs)极大程度地限制了免疫治疗的临床应用。激活细胞的STING通路诱发机体固有免疫反应,是一种逆转肿瘤微环境免疫抑制,提升免疫应答率的新型免疫治疗策略。然而,目前STING激动剂普遍存在类药性差、代谢不稳定、脱靶副作用等缺陷。同时由于STING蛋白在正常细胞和肿瘤细胞内无差异性的表达以及STING激动剂“always on”的药理活性特点, STING激动剂同样会引起免疫相关不良反应,这极大程度上限制了STING激动剂的免疫治疗临床应用,因此迫切需要开发可以在肿瘤部位特异性激活STING通路的免疫治疗方式。
基于以上考虑,南京大学甄叙、蒋锡群研究团队设计了一种可通过超声激活STING通路的半导体共轭聚合物纳米激动剂(Semiconducting Polymeric Nanoagonists, SPNM),用于头颈部鳞状细胞癌的特异性声免疫治疗(图1)。SPNM由半导体共轭聚合物声敏剂和STING通路激动剂MSA-2通过单线态氧响应基团偶联而成。静脉注射SPNM后,SPNM通过被动靶向作用富集到肿瘤区域,在超声作用下,SPNM产生单线态氧,破坏SPNM上的单线态氧响应基团,原位释放出STING激动剂MSA-2,释放的MSA-2会特异性结合肿瘤区域的树突状细胞(Dendritic Cells,DCs)内的STING蛋白,通过促进TANK结合激酶1 (TANK binding kinase 1,TBK1) 和干扰素调节因子3 (Interferon regulatory factor 3, IRF3)磷酸化, 刺激干扰素-β (IFN-β)分泌,同时产生的单线态氧可以引起肿瘤细胞的免疫原性死亡,两者协同促进树突状细胞成熟,提高效应T细胞的增殖和浸润,增强抗肿瘤免疫反应,从而实现超声激活肿瘤部位STING通路的特异性免疫治疗策略。
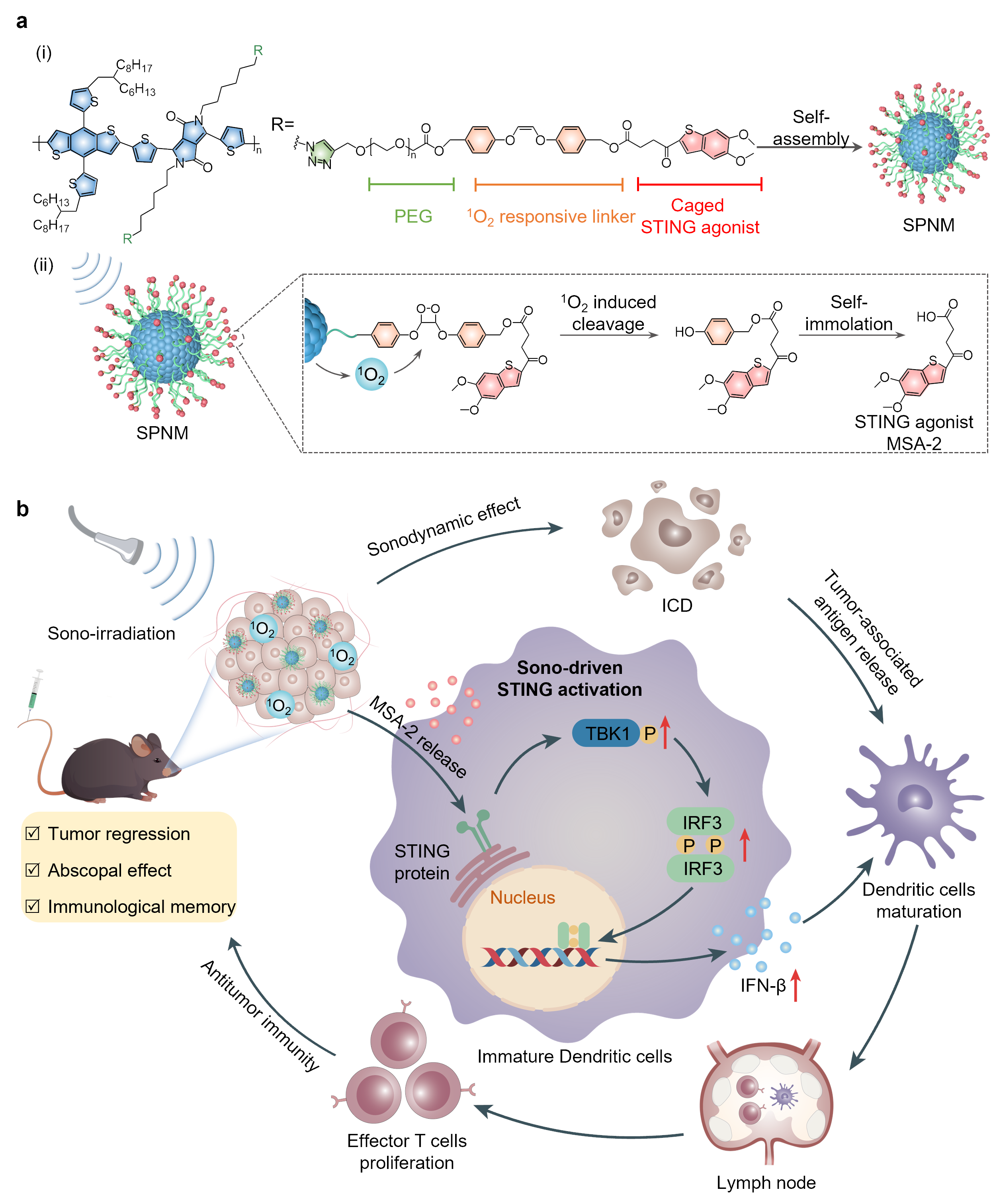
图1. SPNM介导的声驱动STING激活用于头颈部鳞状细胞癌的声免疫治疗示意图。
作者首先成功合成了半导体共轭聚合物纳米激动剂SPNM,并设计合成了不含STING通路激动剂的半导体共轭聚合物纳米材料SPNC和不含单线态氧响应基团的半导体共轭聚合物纳米激动剂SPND,对上述三种纳米材料进行了一系列的基本体外表征(图2)。结果表明三种SPNs均呈球形,且大小均一。紫外吸收光谱显示纳米激动剂SPNM的药物接枝率为6.9%,且在808nm激光照射下SPNs具有近红外二区荧光发射,可用于成像引导肿瘤治疗。此外,超声作用下三种SPNs能够产生大量的单线态氧,通过对SPND和SPNM体外药物释放模式实验发现,产生的单线态氧能有效裂解SPNM中的单线态氧响应基团(EOPD),促使MSA-2释放,而超声作用对于不含单线态氧响应基团的SPND却没有激活效果,无法释放出MSA-2,上述结果证明了单线态氧响应基团对于释放STING激动剂的必要性以及设计的超声释放STING通路激动剂策略的可行性。

图2. SPNs的体外表征。
作者进一步研究了SPNM在细胞层面的声免疫治疗效果(图3)。超声作用下,SPNM治疗组的SCC-7口腔鳞癌细胞内ROS水平显著提升,并引起细胞凋亡。同时在超声刺激下SPNM释放的STING激动剂可有效激活树突状细胞内STING通路,通过提高TANK激酶1(TBK1)和干扰素调节因子3(IRF3)的磷酸化,诱导分泌促炎因子IFN-β,促进树突状细胞的成熟。
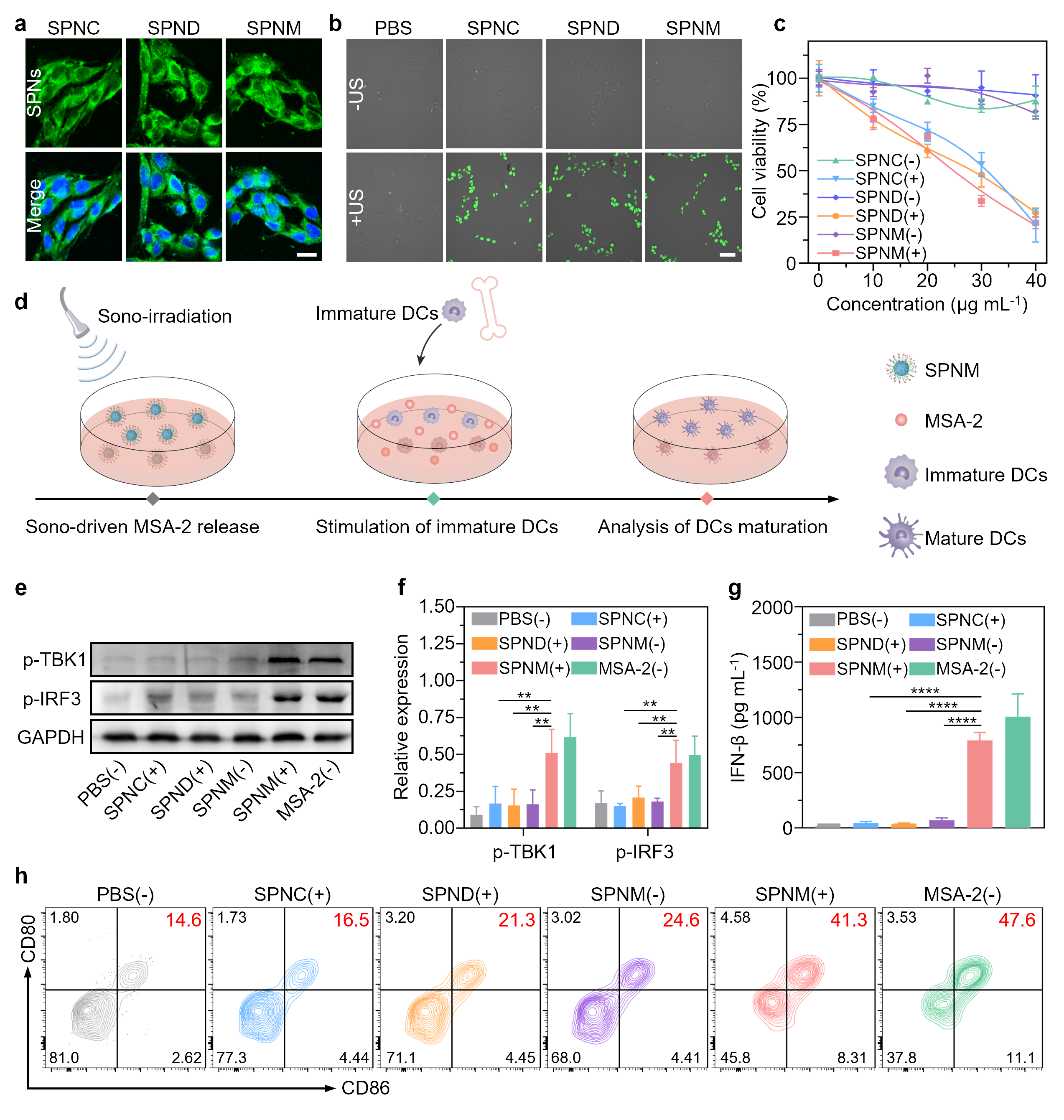
图3. 体外SPNM介导的STING通路激活。
随后,作者通过构建口腔原位双侧瘤小鼠模型对纳米激动剂SPNM的体内抗肿瘤声免疫治疗效果进行了评估(图4)。通过尾静脉注射后,纳米粒子SPNs能够有效地富集到肿瘤部位。当纳米粒子富集量达到最大时,对小鼠近端肿瘤给予超声处理,实验结果表明,SPNM治疗组的治疗效果优于其他任何单一治疗模式,对于近端和远端肿瘤均表现出良好的肿瘤抑制效果。紧接着,作者对肿瘤部位的免疫组织学进行了分析(图5),研究发现SPNM治疗组近端和远端肿瘤内CD8+ T细胞的表达明显升高,通过对肿瘤组织进行免疫荧光染色发现SPNM治疗组损伤相关分子信号表达显著,表明SPNM治疗后增强了肿瘤细胞的免疫原性死亡效应。同时SPNM治疗组肿瘤组织内STING通路相关蛋白p-TBK1和p-IRF3表达含量剂血清中IFN-β含量均有明显提高,表明在超声作用下,SPNM特异性激活了肿瘤部位的STING通路。流式结果也表明近端肿瘤部位DC细胞成熟率在治疗后也得到了明显提高。总体而言,通过SPNM介导的声免疫治疗能够有效激活肿瘤组织部位STING通路,增强体内抗肿瘤免疫反应,从而实现抑制肿瘤生长的效果。

图4. 体内SPNM诱导的抗肿瘤免疫效果评估。

图5. 体内SPNM介导的抗肿瘤免疫机理研究。
鉴于SPNM具备诱导机体强大的声免疫治疗能力,作者接下来构建了口腔单侧瘤小鼠模型对于免疫记忆效果进行评估(图6)。通过对小鼠脾脏部位免疫细胞表达进行分析发现,SPNM治疗组脾脏中效应记忆T细胞表达含量上调,同时对于肿瘤生长情况进行检测发现复发肿瘤得到了明显的抑制,表明SPNM介导的声免疫治疗诱导小鼠形成了长期的抗肿瘤免疫记忆效应。
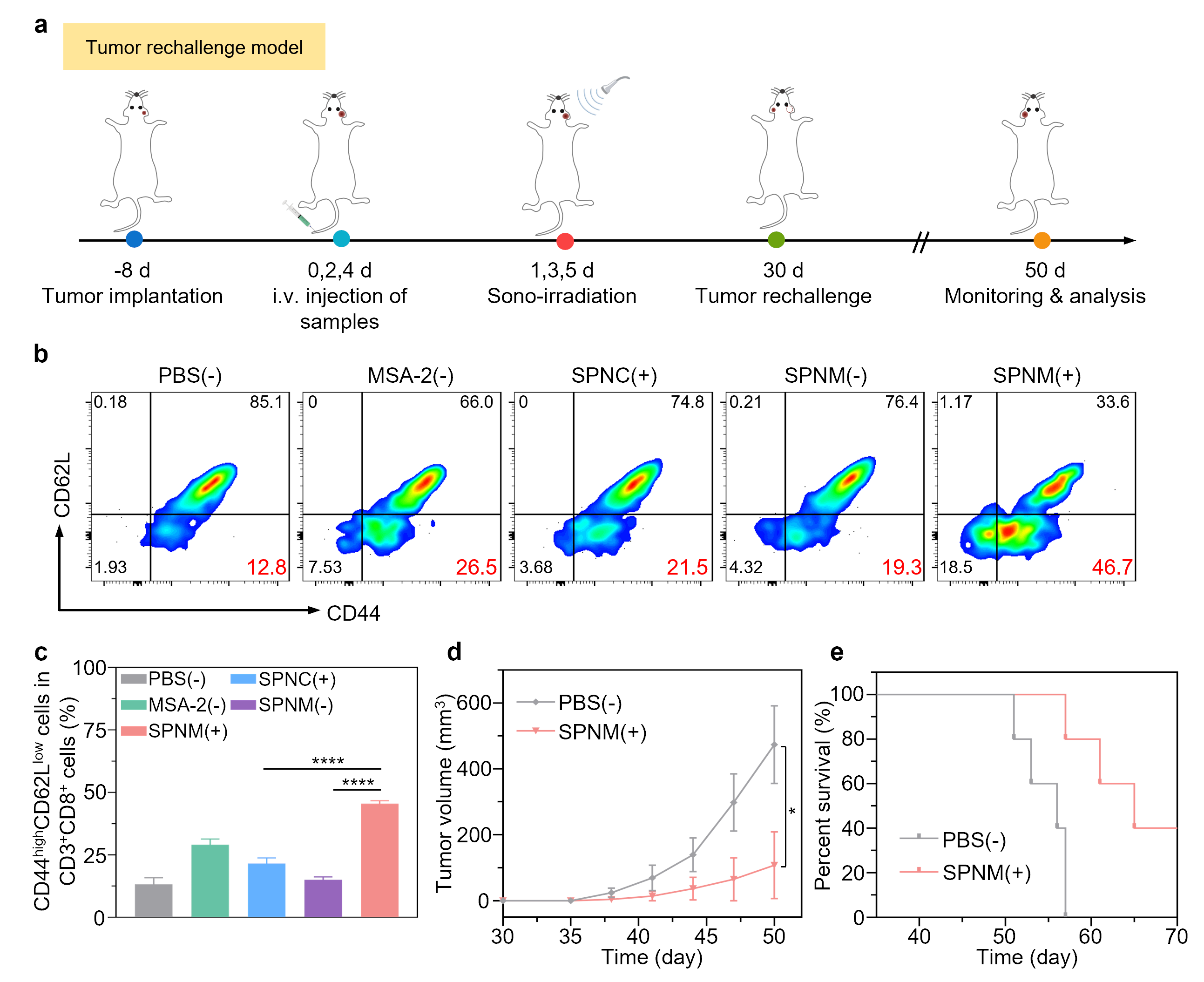
图6. SPNM介导长期免疫记忆效应。
总体而言,SPNM可以通过超声作用在肿瘤部位特异性激活STING通路,提供了一种高效地特异性声免疫治疗策略。该研究成果以“Sono-driven STING activation using semiconducting polymeric nanoagonists for precision sono-immunotherapy of head and neck squamous cell carcinoma”为题发表在Advanced Materials。论文第一作者为南京大学硕士生江建立,共同一作为南京大学附属口腔医院硕士生张苗苗,通讯作者为南京大学甄叙研究员、蒋锡群教授和南京大学附属口腔医院王翔主任医师。本论文得到国家重点研发计划,国家自然科学基金,中央高校基本科研基金等项目资助。
原文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202300854






