寻找理想的骨再生性植入物仍然是临床上一个持续的挑战。天然骨组织的微观结构中,坚实的无机成分(羟基磷灰石)主要负责支撑、保护和承重,而柔软的有机成分(胶原纤维,多糖)在干细胞的增殖和迁移中起着重要作用。因此,有效地模拟天然骨软硬结合的杂化的结构与功能,有助于调控干细胞命运来改善骨再生进程。3D打印技术可以用于组织工程支架结构的精确控制,特别是创建有序孔隙和用户自定义结构,被广泛应用于组织工程领域。然而,目前以PCL,PLA等为主的挤出式3D打印支架难以提供组织重塑过程中长期稳定的营养供给,同时其表面缺乏活性配体,这会导致无效的细胞粘附和下游细胞事件,难以模拟骨组织再生过程所需的生理微环境。
针对以上问题,四川大学生物医学工程学院/国家生物医学材料工程技术研究中心孙勇研究员/樊渝江教授在前期的工作基础上(Nat. Commun., 2022; Adv. Funct. Mater., 2023),利用多巴胺介导的化学整合,将仿生胞外基质凝胶修饰在聚多巴胺涂层的3D打印PCL支架中,构建了软-硬结合的活性骨修复体(BM-g-DPCL,图1)。该策略改善了3D打印支架植入后的再生微环境,对于成骨基质的重塑起到重要作用。其中,梯度多孔结构设计有利于潜在的细胞迁移和营养传质;聚多巴胺涂覆的“硬”性PCL支架促进钙离子螯和及随后的类骨质沉积,并维持植入体的力学环境;多酚基团化学锚定的“软”性凝胶基质改善再生微环境,增强了干细胞的粘附、增殖和成骨分化。活性骨修复体(BM-g-DPCL)加速内源性干细胞(ESCs)募集,并启动了快速的血管形成(图2)。在兔颅骨缺损模型(Φ = 10 mm)中,活性支架促进新生组织与植入体界面融合,诱导新生骨基质在支架内部沉积(图3)。蛋白质组学确认细胞因子粘附、生物矿化沉积、快速血管化及促进胞外基质形成是加速骨缺损愈合的主要因素(图4)。这种仿生的软硬组分高度化学键和的策略提供了无细胞/无因子的组织工程支架再生的新策略。

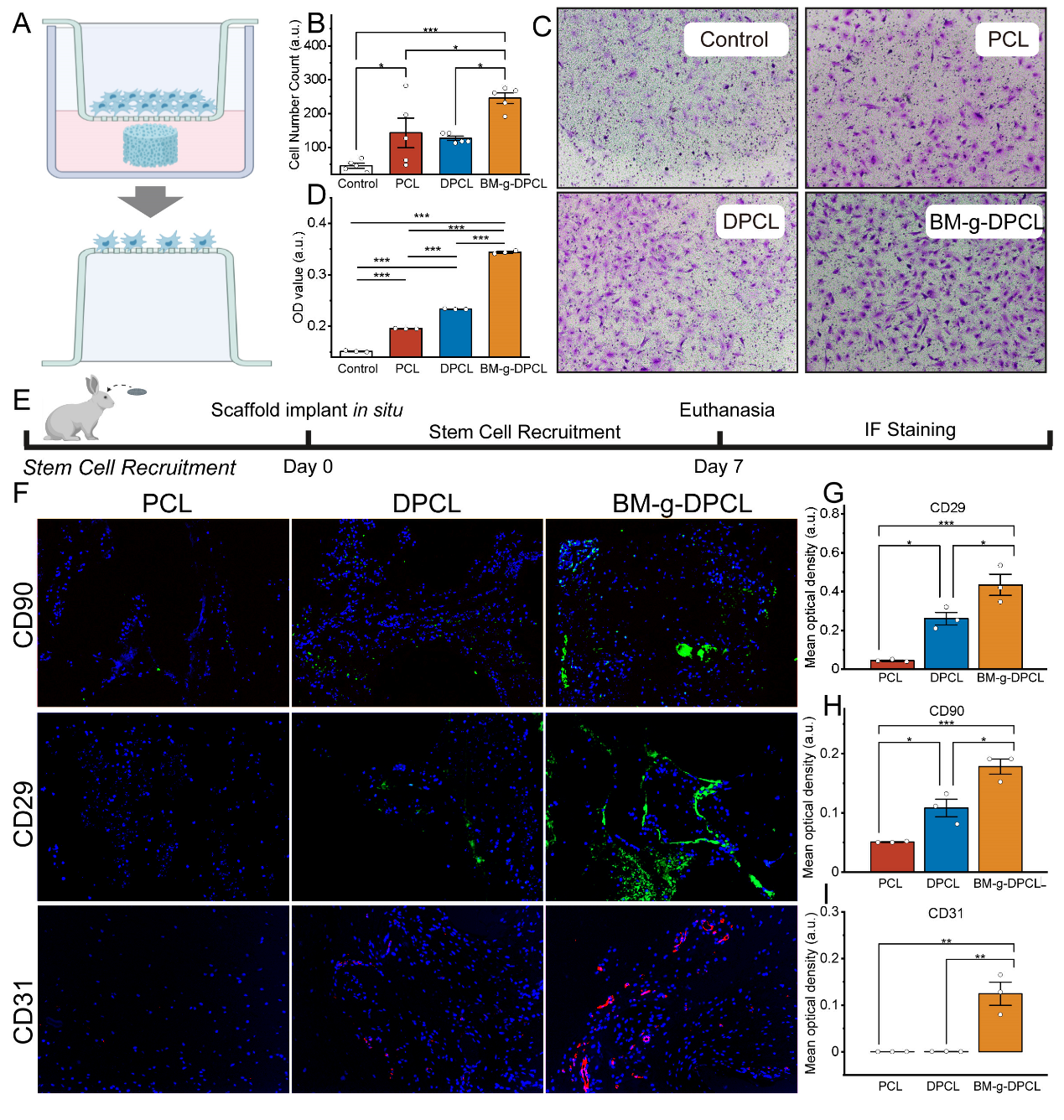
图2 仿生基质加速rBMSCs体外迁移和体内内源性干细胞(ESCs)募集


图4 差异的蛋白表达揭示成骨分化机制
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/smll.202206960
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
- 哈工大潘昀路教授团队 AFM:从“破乳”入手的肾小球仿生纳米纤维膜 - 实现微纳乳液高通量分离 2026-02-25
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 中国海洋大学徐晓峰教授团队 AFM:吸湿复合材料同轴3D打印 2026-02-26
- 兰州大学范增杰团队 Adv. Mater.:3D打印动态适应性梯度压电支架用于肌腱高效再生修复 2026-02-15
- 中科大/理化所董智超、中科大李储鑫 Adv. Mater.:3D打印旋转扇叶 - 低能耗吸雾除湿,并实现油雾稳定捕集 2026-02-02
- 西安交大郭保林教授《Natl. Sci. Rev.》:细菌响应程序化自激活抗菌水凝胶用于重塑伤口再生微环境以促进感染伤口愈合 2024-02-16
