光热治疗凭借其局部、高效、副作用小等优势成为了肿瘤治疗领域的热点,免疫治疗作为一种新型抗肿瘤技术,能通过激活机体的免疫功能,增强免疫系统对肿瘤细胞的识别功能发挥抗肿瘤效果。最新研究表明光热治疗不仅能对肿瘤组织造成损伤,也可通过诱导肿瘤细胞免疫原性死亡(immunogenic cell death, ICD)而刺激机体的免疫功能,将光热治疗与免疫治疗结合能达到协同抗肿瘤作用。然而肿瘤细胞的低免疫原性和较低的免疫响应限制了光热免疫治疗的疗效。
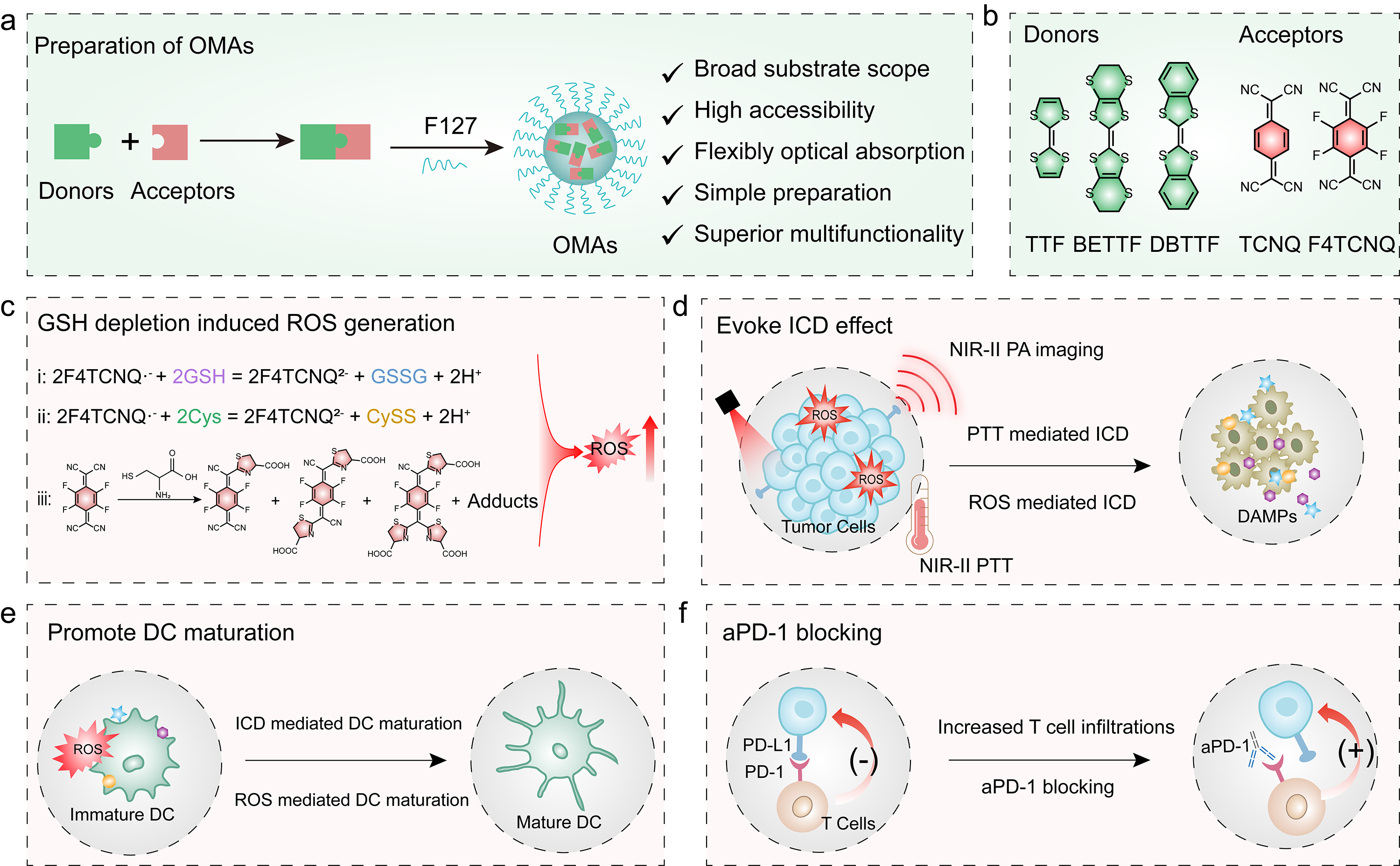
图 1. 有机金属纳米佐剂介导的NIR-II光热免疫治疗示意图。
针对这些问题,华南理工大学生物科学与工程学院朱伟教授和新加坡南洋理工大学赵彦利教授共同设计研发了具有消耗谷胱甘肽能力的有机金属纳米佐剂(OMAs)用于NIR-II光热免疫治疗(图1)。
该研究通过调控不同的电子受体和电子给体实现超分子组装获得具有NIR-II光热治疗和光声成像性能的有机金属纳米粒子,其具有制备简单,底物范围广,易于获得,可调控光学性质等优势。获得的OMAs还具有氧化谷胱甘肽和半胱氨酸的性能,同时也可以与半胱氨酸发生缩合,在细胞中阻碍了谷胱甘肽的合成,其既促进了谷胱甘肽的消耗也降低了谷胱甘肽的合成,造成了氧化还原失衡,促进了细胞内ROS的升高(图2)。
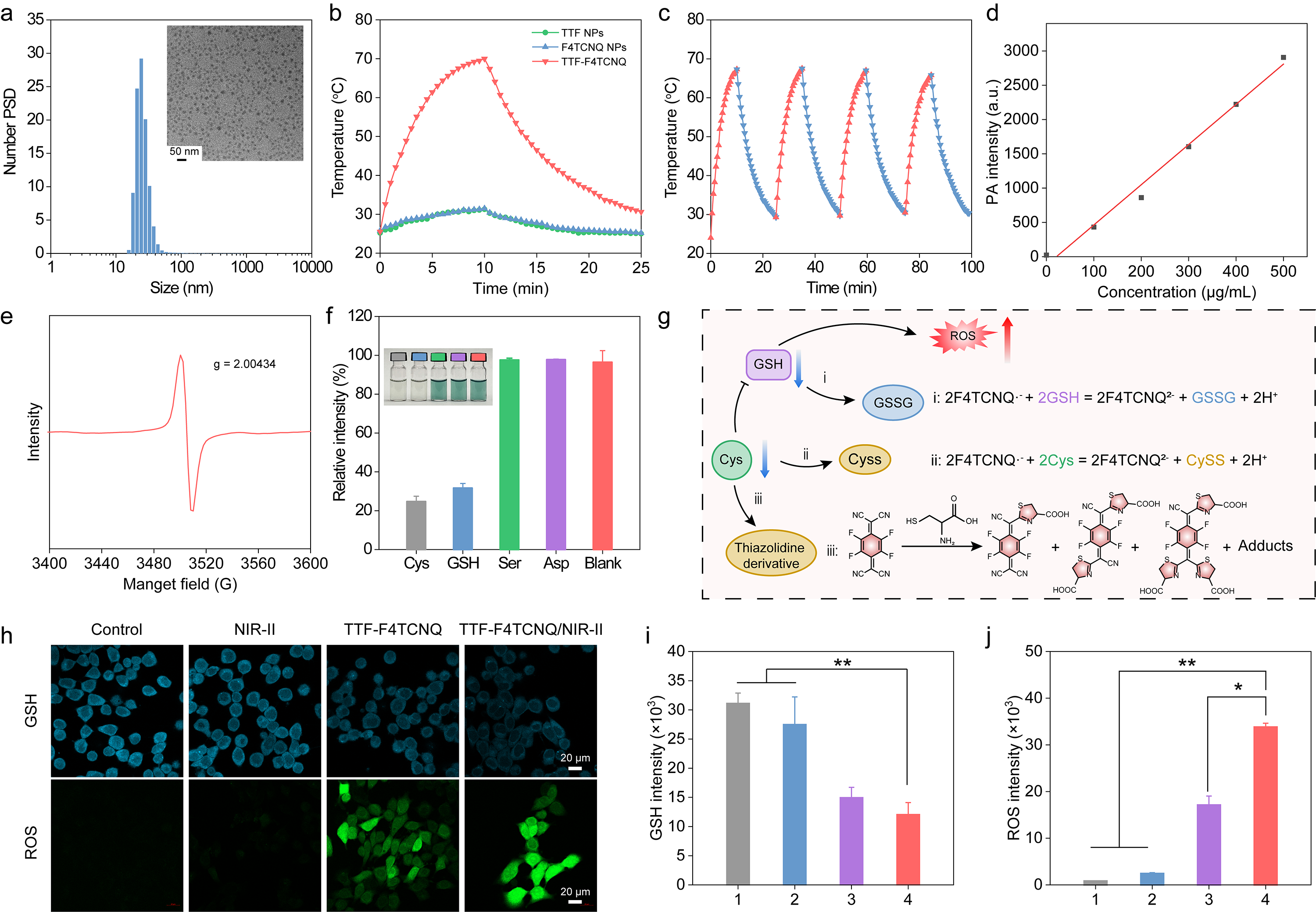
图 2. OMAs的制备及性能表征。
OMAs通过协同谷胱甘肽消耗与NIR-II光热治疗,不仅促进了ICD效应,增强了肿瘤细胞的免疫原性,也促进了树突状细胞的成熟,进一步增加了T细胞的浸润,增强了免疫响应(图3)。此外,通过协同免疫检查点抑制剂(aPD-1),其不仅清除了原位瘤,也进一步的抑制了远端瘤,获得了有效的光热免疫治疗效果(图4)。所制备的有机金属纳米佐剂不仅为增强光热免疫治疗疗效提供了一个有效的策略,同时也指导开发了有机金属库,以满足肿瘤治疗中的多方面需求。

图 3. OMAs激活免疫原性死亡及促进树突状细胞成熟的表征。

图 4. OMAs的体内光声成像及抗肿瘤表征。
以上相关成果以“Glutathione-Depleting Organic Metal Adjuvants for Effective NIR-II Photothermal Immunotherapy”为题发表于《Advanced Materials》上,该论文第一作者为华南理工大学生物科学与工程学院陈韵博士,通讯作者为华南理工大学生物科学与工程学院朱伟教授和新加坡南洋理工大学赵彦利教授。该研究得到了国家自然科学基金等项目支持。
