能在湿润动物组织表面形成强韧湿黏附(wet adhesion)的水凝胶受到了越来越多的关注。目前主要由两种策略实现水凝胶强韧的湿黏附,一是将制备好的黏附水凝胶按压在组织上;二是将水凝胶前体溶液滴在湿润组织表面,然后再给予刺激,使溶液原位形成水凝胶并粘附在组织上。但是,组织上的界面水(interfacial water)和通过化学键交联的水凝胶网络极大地限制了水凝胶和湿润组织之间的黏附作用。为了消除界面水和化学交联对水凝胶形成强韧黏附的限制,边黎明教授团队制备了一种能吸收动物组织表面的界面水并在原位形成具有强韧黏附水凝胶的聚乙烯亚胺/聚丙烯酸(PEI/PAA)粉末。
PEI/PAA粉末的制备过程如图1a所示,将PEI和PAA水溶液充分混合得到PEI/PAA复合物。随后将PEI/PAA复合物经过冷冻干燥和粉碎后,就能得到PEI/PAA粉末。基于高分子之间强物理作用和高分子的扩散,PEI/PAA粉末能快速吸水并在2秒内形成水凝胶(图1)。
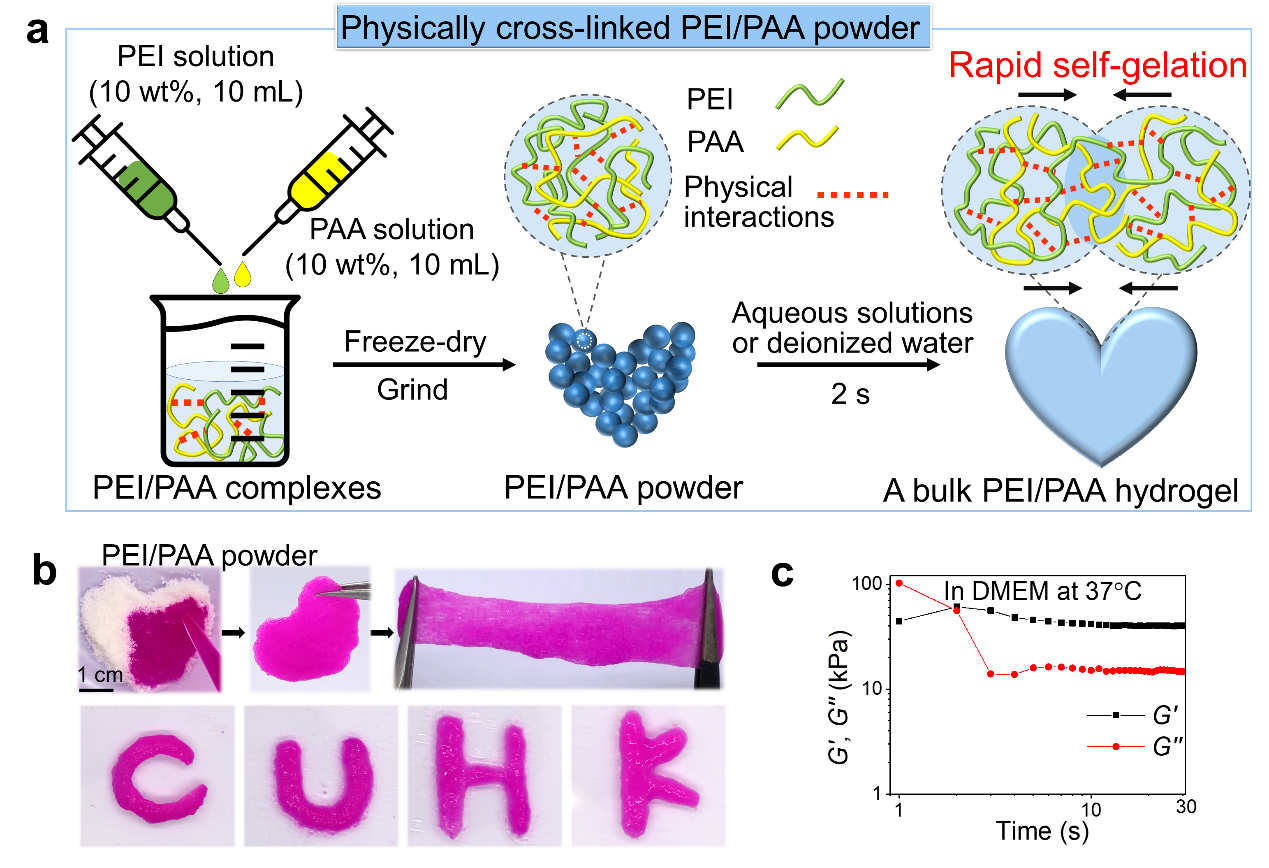
图1. PEI/PAA粉末的制备及其遇水形成水凝胶的过程。
将PEI/PAA粉末洒在湿润的基板上后,PEI/PAA粉末能快速吸收界面水形成PEI/PAA水凝胶。同时,PEI/PAA水凝胶表面的官能团能和基板表面的官能团通过物理作用结合,从而能在2秒内促发黏附。随后,水凝胶中通过物理作用交联的高分子能扩散到基板的网络里,和基板的网络形成互穿网络,增强水凝胶的黏附作用。将粉末洒在聚丙烯酰胺水凝胶和多种动物组织表面后,PEI/PAA粉末能快速吸收界面水在原位形成水凝胶并黏附在基板上。随后将样品浸泡在溶液30天或者12小时,水凝胶仍然能牢固地黏附在基板上(图2)。除此之外,PEI/PAA粉末还能作为密封剂,有效地修补猪胃和猪小肠的穿孔。

图2. PEI/PAA粉末的湿黏附机理及其黏附行为。
为了进一步证实PEI/PAA粉末作为密封剂的有效性,以大鼠的胃穿孔为模型,对比了传统缝线、纤维蛋白胶(fibrin glue)和PEI/PAA粉末促进胃穿孔愈合的效果。治疗7天后,从宏观来看,用PEI/PAA粉末治疗的伤口比缝合线和纤维蛋白凝胶治疗组表现出更好的愈合效果。H&E染色显示,用PEI/PAA粉末治疗组的胃黏膜完全桥接,但是缝线组和纤维蛋白胶组穿孔处的黏膜并未愈合。另外,PEI/PAA粉末治疗组在肉芽组织中显示出最高的PCNA(增殖细胞核抗原,G1/S期的增殖细胞的标志物)阳性上皮细胞百分比和最高的血管密度。综上,PEI/PAA粉末能有效地密封胃穿孔并促进伤口的愈合(图3)。

图3. 利用PEI/PAA粉末、缝线和纤维蛋白胶治疗大鼠胃穿孔的对比。
由于该粉末具有极强的湿黏附且制备使用极其简单,相信该粉末的应用能被进一步拓展到止血剂、药物载体和可穿戴器件等应用上。这项研究结果于近期以“Ultrafast self-gelling powder mediates robust wet adhesion to promote healing of gastrointestinal perforations”为标题发表在《Science Advances》上。
该工作第一作者为香港中文大学生物医学工程系彭欣博士,合作通讯作者是香港中文大学外科学系赵伟仁教授,通讯作者边黎明教授。
文章链接:https://advances.sciencemag.org/content/7/23/eabe8739
作者简介:
边黎明教授2021年入职华南理工大学生物医学科学与工程学院,现任长江学者特聘教授。边教授长期致力于发展先进纳米材料与水凝胶材料在生物医学领域的应用,并且逐渐建立了从基础材料学,生物医学研究到医疗应用研究的多方向的深度研究。边教授课题组近期在高水平学术期刊发表多篇论文。
1. +Wong, S.H.D.; +Xu, X.; Chen, X., Xing, Y.; Xu, L.; Lai, N.C.H.; Oh, J.; Wong, R.W.K.; Wang, X.; Han, S.; You, W., Shuai, X.; Wong, N., *Tan, Y.; *Duan, L.; *Bian, L. Manipulation of the nanoscale presentation of integrin ligand produces cancer cells with enhanced stemness and tumorigenicity. Nano Letters, 2021.
2. +Zhao, P.; +Yang, B.; Xu, X.; Lai, N.C.H.; Li, R.; Yang, X.; *Bian, L. Nanoparticle-assembled vacuolated coacervates control macromolecule spatiotemporal distribution to provide a stable segregated cell microenvironment. Advanced Materials, 2021, 33, 9, 2007209
3. +Yuan, W.; +Wang, H.; +Fang, C.; Yang, Y.; Xia, X.; Yang, B.; *Lin, Y.; *Li, G.; *Bian, L. Microscopic local stiffening in supramolecular hydrogel network expedites stem cell mechanosensing in 3D and bone regeneration. Materials Horizons, 2021.
4. Bioadhesive hydrogels demonstrating pH-independent and ultrafast gelation promote gastric ulcer healing in pigs. Science Translational Medicine, 2020, 12, 558, eaba8014.
5. Immunoregulation of macrophages by dynamic ligand presentation via ligand-cation coordination. Nature Communications, 2019, volume 10, Article number: 1696.
6. Conformational manipulation of scale-up prepared single chain polymeric nanogels for multiscale regulation of cells. Nature Communications, 2019, volume 10, Article number: 2075.
7. Synthetic presentation of noncanonical Wnt5a motif promotes mechanosensing-dependent differentiation of stem cells and regeneration. Science Advances, 2019, 5: eaaw3896.
8. Dynamic and cell-infiltratable hydrogels as injectable carrier of therapeutic cells and drugs for treating challenging bone defects. ACS Central Science, 2019, 5 (3), pp 440–50.
9. Remote control of heterodimeric magnetic nanoswitch regulates the adhesion and differentiation of stem cells. J. Am. Chem. Soc., 2018, 140 (18), 5909-5913.
10. In situ reversible heterodimeric nanoswitch controlled by metal ion-ligand coordination regulates the adhesion, release, and differentiation of stem cells. Advanced Materials, 2018, 30(44), adma.201803591.
- 燕山大学秦志辉、焦体峰教授/UCLA贺曦敏教授 Sci. Adv.:可快速、规模化制备的高强韧超薄离子凝胶膜用于高性能生物电子器件 2026-03-03
- 浙大郑强/太原理工朱凤博团队 CEJ:碱激发粉煤灰催化的强韧复合水凝胶的可持续与规模化制备及其应用 2026-02-28
- UCLA 贺曦敏教授团队 Adv. Mater.:从“链段运动”入手 - 一种刷新各向同性纪录的超强韧PVA水凝胶 2026-02-26
- 北海道大学龚剑萍/深圳大学范海龙 Macromolecules:基于凝聚层自发相变的水/油下强黏附凝胶 2025-10-03
- 西安交大卢同庆教授团队《Sci. Adv.》:生物黏附界面设计实现膨体聚四氟乙烯医用植入物的即时牢固固定 2025-06-24
- 北化秦培勇/司志豪 AFM:基于层间化学共价作用构筑高性能TFC复合膜 2025-02-18
- 新医大一附院盛伟斌教授/华科大马良教授 AFM:构建了仿生多功能水凝胶贴片-在脊髓损伤治疗方面取得新进展 2026-03-02
