膨体聚四氟乙烯(e-PTFE)凭借其优异的生物惰性而被广泛用于血管替代物、外科补片、假体等医用植入物的制造。在手术中,这些e-PTFE植入物需要在目标组织处固定以实现相应功能。现有的固定方法主要依赖针线缝合、螺旋锚钉或金属骨架支撑等侵入性锚定手段,存在操作耗时、体液渗漏及组织损伤等缺陷。

近日,西安交通大学卢同庆教授团队与西京医院雷伟教授团队合作提出了一种基于水凝胶生物黏附界面的e-PTFE植入物粘接固定策略。一般情况下,e-PTFE材料因具有非极性且稳定的分子结构而高度疏水及生化惰性,难以在其表面形成粘接。研究团队利用e-PTFE的孔隙特性,提出一种冷冻诱导微观机械互锁的界面粘接方法,在该疏水材料表面构建高含水的生物黏附水凝胶界面层。该水凝胶层与e-PTFE的结合界面十分强韧(界面粘接能>300 J/m2),将水凝胶层剥离需要破坏界面微观互锁结构,从而引发基体大范围的能量耗散(图1B)。与此同时,该水凝胶层能够选择性涂覆于e-PTFE薄膜的单侧表面,使得水凝胶/e-PTFE薄膜表现出Janus特性(图1C)。通过这种水凝胶界面层的设计,能够实现e-PTFE医用植入物在目标组织上的即时、牢固、无损固定(操作时间<10秒,组织界面粘接能>200 J/m2)(图1D)。
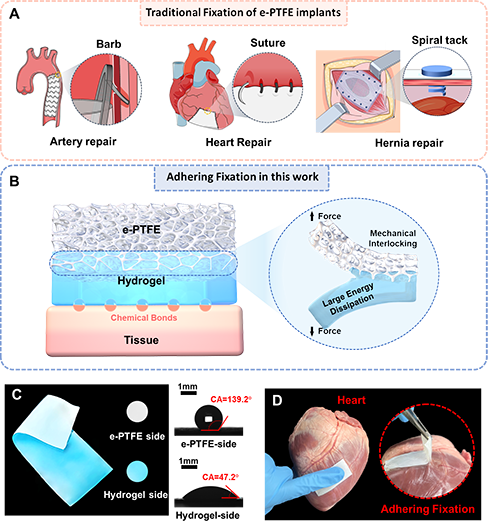
图1. 基于水凝胶生物黏附界面的e-PTFE植入物粘接固定。
冷冻诱导微观机械互锁方法用于制备水凝胶界面层
e-PTFE是一种具有微米级孔隙(0.2-30 μm)的薄膜材料。由于其高度疏水性,水凝胶前驱体溶液通常无法浸润微孔。本研究利用水结冰时的体积膨胀效应作为驱动力,将水凝胶分子链挤入微孔。实验选取了聚乙烯醇(PVA),一种典型的具有冷冻成胶特性的高分子为基础来构建水凝胶界面层。在低温环境下,PVA 水溶液中的水将发生液固相变,导致体积膨胀。冰晶的生长以及封闭装置内压力的增加,迫使 PVA 分子链相互靠近,同时将其挤入 e-PTFE 的疏水微孔中。相邻的 PVA分子链间形成氢键结晶而发生交联。当温度恢复至室温时,被挤入的PVA分子链无法回弹,而是与微孔形成了永久性的微观机械互锁结构(图2A)。由此,界面连接和水凝胶基体可得到同步强化,从而获得优异的界面粘接性能。SEM图像证实,界面区域形成了致密的微观结构,通过元素能谱扫描进一步观察到了来自 e-PTFE 多孔骨架的氟元素,这表明水凝胶网络与 e-PTFE 之间具有很高的互锁程度(图2B)。剥离测试测得水凝胶层与 e-PTFE 之间的粘接能可达 320 J/m2(图2C)。
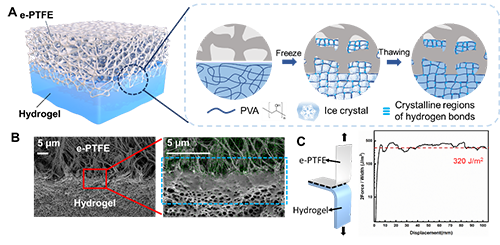
图2. 通过冷冻诱导微观机械互锁作用在e-PTFE膜表面制备水凝胶界面层
为了赋予水凝胶界面层以生物黏附特性,进一步采用双网络设计,在PVA初级网络中互穿了一层具有组织黏附官能团的次级高分子网络。本研究参考了一种氢键和共价键相结合的方法,选择了丙烯酰化甘氨酸衍生物单体[N-丙烯酰基-2-甘氨酸(ACG)]和丙烯酸 N-羟基琥珀酰亚胺酯(AAc-NHS)共聚形成次级网络 PACG-NHS。具有该水凝胶界面层的e-PTFE膜(BIe-PTFE)通过10 秒按压即可与组织强粘接,在与多种活体组织,如猪动脉、皮肤、胃和肌肉的粘接测试中,其粘接能范围在 70 至 220 J/m2。
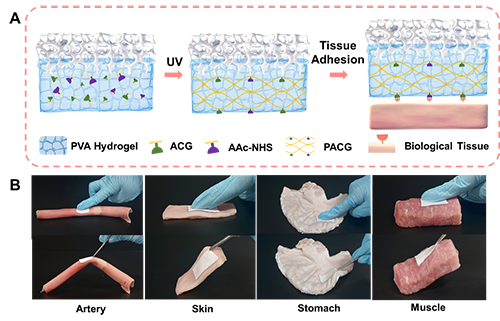
图3. 通过双网络设计实现水凝胶界面层的生物黏附性能
基于水凝胶界面层的e-PTFE植入物粘接固定
为了展示这种固定方法的潜在优势,首先采用体外模型进行了原理验证。猪动脉被选作代表性的测试组织,因为它是体内承受最极端力学环境的组织之一。通过装置在离体猪动脉中模拟动脉循环的脉冲频率和压力。对于一个5毫米直径的缺损,如采用BIe-PTFE进行修补,通过将其按压到缺损处10秒钟即可完成封闭,且能够在PBS 溶液的浸泡中稳定承受血压超 24小时(图4A)。而采用传统e-PTFE缝合修补,缝线部位则易发生漏液(图4B)。在覆膜支架植入模型中,当采用BIe-PTFE作为覆膜时,支架通过与动脉内表面形成强粘接而固定,可在 120 mmHg血压下保持覆盖动脉缺损超24小时(图4C)。而采用传统e-PTFE作为覆膜时,支架易在血流冲刷下滑移(图4D)。使用 BIe-PTFE可降低支架的过膨胀率,从而可能减少对血管的不良影响。
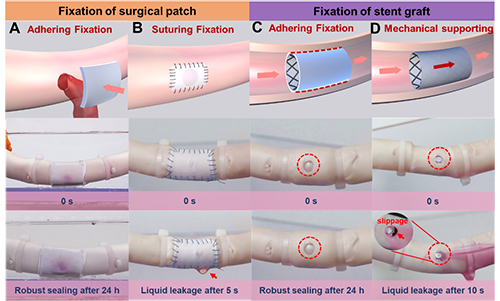
图4. BIe-PTFE用于医疗植入物粘接固定方面的潜在优势
进一步在临床环境中将 BIe-PTFE 用作手术补片,用于修复兔子的腹壁缺陷。对于一个 20 毫米直径的兔腹壁缺损,通过将BIe-PTFE在缺损部位按压 10 秒可实现牢固固定和紧密密封(图5A)。作为对照,采用缝线将e-PTFE 固定在缺损部位则需要超过 10 分钟的操作时间,且密封效果取决于个人经验(图5E)。术后7天重新打开手术部位观察,可发现BIe-PTFE 治疗组的组织分层清晰,无明显组织黏连(图5B);而e-PTFE治疗组发生了较严重的组织黏连(图5F)。组织学分析表明,相比于水凝胶界面层,缝线穿刺在周围组织中引起了更严重的炎症反应和过度纤维化,从而引发了术后黏连(图5CDGH)。
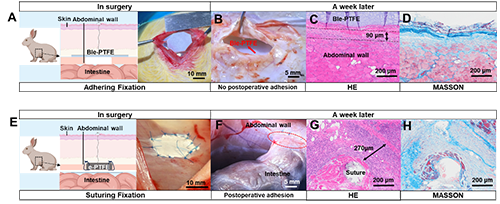
图5. BIe-PTFE在兔腹壁缺损修复中的应用
该研究成果以“Instant and secure fixation of e-PTFE medical implants in surgery by designing a bioadhesive interface”为题发表于国际知名期刊Science Advances。西安交通大学副教授高扬为论文第一作者,第四军医大学西京医院张扬副教授,西安交通大学教授卢同庆为论文通讯作者。该研究工作得到了国家自然科学基金(12172274,82172393)的资助与支持。
论文链接:https://www.science.org/doi/epdf/10.1126/sciadv.adw3845
- 暂无相关新闻
