近年来,蛋白或基于蛋白的诊疗试剂(PBTA)受到越来越多科研工作者的关注。这其中,包括治疗蛋白如细胞因子、单抗、生物酶等,可以作为生物大分子药物,在抗肿瘤治疗中表现出优良的活性。另外一些则是生物相容性蛋白,如白蛋白、血红蛋白、转铁蛋白等,可以作为治疗性小分子药物、染料或诊断剂的载体。然而,目前已报道的蛋白诊疗剂由于其在肿瘤中蓄积、渗透或选择性差等种种问题,很大程度上限制了其体内应用以及临床转化。我们知道,纳米粒子的粒径在肿瘤滞留、渗透中扮演着至关重要的角色。通常来讲,粒径较小的纳米粒子具有较强的渗透能力,却同时伴随着较差的肿瘤滞留;而粒径较大的粒子恰恰相反,表现出较强滞留及较差渗透。目前已开发的大部分蛋白诊疗试剂粒径均分布在2-20 nm,该小粒子很容易通过肾清除排出体内,其体内生物半衰期不到1小时,使得疗效大打折扣。
近期,中国药科大学药学院孙敏捷教授团队利用动态组装技术,开发出一种细胞外微环境ATP超敏蛋白团簇(DEP/GdCuB)成功攻克这一瓶颈,同时实现了蛋白粒子在肿瘤部位有效蓄积及深层渗透,并用于放大T1加权磁共振成像(MRI)引导的光热治疗(图1)。这一成果近日发表于Advanced Functional Materials杂志。

图1. 胞外ATP超敏型蛋白团簇(DEP/GdCuB)制备及在体内工作原理示意图:(A)在血液循环中:将荷载Gd和CuS的白蛋白纳米小粒子(9 nm)制备成蛋白团簇(120 nm),能够有效延长蛋白的血液循环时间,从而增强其在肿瘤部位蓄积,与此同时,制备成较大粒子能够减弱Gd的T1加权MRI效果,降低背景信号;(B)当蛋白团簇到达肿瘤部位,肿瘤微环境0.1-0.4mM ATP能够迅速反转DEP阳离子材料电荷,触发蛋白小粒子释放,实现深层渗透的同时,“大变小”策略激活Gd的T1加权MRI成像,点亮肿瘤,实现MRI引导的光热治疗。
肿瘤微环境(0.1-0.4 mM)及肿瘤细胞内(1-10 mM)均富含ATP分子,课题组前期研究发现,ATP分子中同时包含能与苯硼酸(PBA)特异结合的二醇分子以及强负电性三磷酸分子,修饰苯硼酸的阳离子聚合物能够在富含ATP环境下迅速实现电荷反转(正转负),通过静电排斥触发负电性siRNA释放。基于上述概念,孙敏捷教授团队成功开发出能够针对肿瘤细胞内高浓度ATP选择性激活的siRNA转染载体(ACS Appl. Mater. Interfaces 2018, 10, 32026?32037;Theranostics 2018; 8(17): 4604-4619)。进一步研究发现,很多生物大分子药物,如蛋白中也包含负电性区域,因此,该ATP敏感体系在蛋白递送中是否同样具有应用前景值得进一步探究。
首先,该团队在天然多糖糊精上修饰乙二胺作为阳离子材料,同时修饰不同取代度的苯硼酸,以调节ATP敏感性,得到ATP敏感载体DEP。将Gd和CuS分别作为MRI成像模块以及光热治疗元件包载在BSA纳米粒中,形成诊疗一体化蛋白小粒子(GdCuB)。蛋白小粒子包裹在DEP材料中,形成蛋白团簇DEP/GdCuB。最终通过筛选,选取较高PBA取代度的DEP材料用于实验,实验证明其具有ATP超敏感性能,能够快速响应肿瘤微环境0.1 mM ATP。如图2A所示,加入ATP后,DEP发生电荷反转,从而导致GdCuB蛋白的快速释放(图2B)。从TEM形貌观察中也能发现,GdCuB为9 nm,DEP/GdCuB为120 nm左右,同时,在团簇中加入ATP后, 大量小粒子从团簇中释放(图2C),证明了ATP可触发团簇解体及蛋白释放。通常来讲,将T1成像剂Gd包载在小粒径BSA中,由于其具有较大的比表面积,能够大大缩短弛豫时间,因此具有很 好的成像效果;而形成团簇之后,比表面积减小,Gd离子与水分子接触几率降低,成像效果减弱。这里,通过血液循环中“小变大”和肿瘤微环境“大变小”的动态组装策略,能够实现肿瘤区域ATP选择性激活T1成像效果(图3A,3B)。更值得一提的是,“小变大”与“大变小”的动态组装能够同时实现肿瘤的蓄积与深层渗透(图3C)。此项研究工作不仅提供了一种平衡纳米粒子在肿瘤渗透及滞留的新策略,而且为下一代蛋白诊疗试剂的开发提供了一个实例,对优化蛋白诊疗试剂的临床应用具有重要的参考意义。此外,该策略是否能够普适的应用于表面负电性修饰的纳米粒子(如:Fe3O4, 金纳米,量子点等),仍然值得进一步探究。
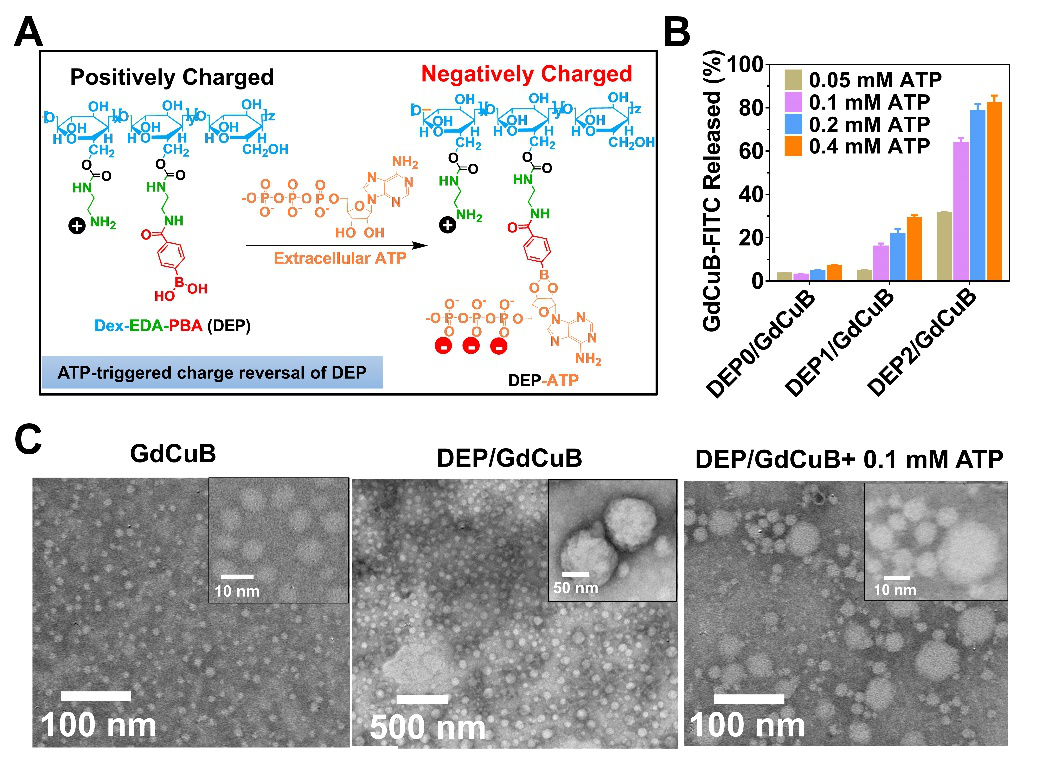
图2. (A)ATP触发阳离子材料DEP电荷反转示意图;(B)ATP触发蛋白小粒子GdCuB释放;(C)TEM观察蛋白小粒子和蛋白团簇形态,以及加入ATP后团簇形态变化。

图3. (A)不同浓度GdCuB、DEP/GdCuB以及DEP/GdCuB+ATP溶液的T1加权磁共振成像;(B)T1加权磁共振成像弛豫系数计算;(C)3D肿瘤细胞球观察DEP/GdCuB-FITC蛋白团簇在有无ATP存在下的渗透。
中国药科大学博士生周占威为本论文第一作者,孙敏捷教授为本文的通讯作者。
该研究得到了国家重点研发计划“纳米专项”(2017YFA0205402)、国家自然科学基(81872817, 81573377, 81803477)、江苏省杰出青年基金(BK20170028)等资助。
论文题目为“Size Switchable Nanoclusters Fueled by Extracellular ATP for Promoting the Deep Penetration and MRI Guided Tumor Photothermal Therapy”https://doi.org/10.1002/adfm.201904144
- 东华大学史向阳教授/沈明武研究员团队 AFM: 双驱动纳米马达用于高效肿瘤光热治疗及治疗后炎症缓解 2025-03-17
- 香港科大唐本忠院士团队/武大王富安课题组 JACS:设计一种AIE螺环近红外发射探针用于DNAzyme敏化增强的乳腺癌光热治疗 2024-12-14
- 北航潘曹峰教授/河南大学曹瑞瑞副教授团队 AFM:用于运动能量收集和光热治疗的摩擦电功能纺织品 2024-12-07
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 长春应化所陈学思、丁建勋团队 JACS:一种肿瘤选择性自组装聚氨基酸网络通过微囊泡分裂扩增诱导级联旁观者细胞毒性 2026-01-12
- 福大林立森/新国大陈小元 Nature大子刊:当手性水凝胶遇上细胞膜仿生-可术后空腔植入的生物杂化水凝胶如何调节肿瘤干细胞信号 2025-12-30
- 西工大李鹏教授课题组 Sci. Adv.:可选择性杀灭ESKAPE耐药菌的含氟两亲性阳离子聚合物 2024-09-01
