恶性黑色素瘤作为最具侵袭性的皮肤恶性肿瘤之一,其传统治疗手段临床疗效往往有限。化学动力学疗法(CDT)因其优异的肿瘤选择性和低毒性而备受关注,但单一疗法效果受限,主要归因于复杂的肿瘤微环境中过表达谷胱甘肽(GSH)、酸性pH及缺氧诱导的免疫抑制。因此,迫切需要开发能整合化学动力学治疗与其他治疗策略的多功能纳米平台,实现肿瘤精准成像与高效特异性治疗。
CRISPR/Cas9基因编辑技术能够特异性敲除PD-L1基因,从而永久性阻断PD-1/PD-L1免疫检查点通路,从根本上抑制肿瘤的免疫逃逸。基于上述特性,该技术对免疫原性极强的黑色素瘤尤为使用。然而,肿瘤微环境(TME)的复杂病理特征,尤其是免疫抑制分子腺苷(ADO)的过度积累,严重限制了该技术的疗效。在缺氧的TME中,CD39/CD73可将促炎性ATP代谢为ADO,显著抑制免疫细胞功能。研究表明,改善肿瘤缺氧状态可有效下调CD39/CD73表达,进而阻断ADO介导的免疫抑制效应。
基于此,东华大学郭睿教授/史向阳教授课团队构建了一种基于MnO2纳米颗粒与CRISPR/Cas9-PD-L1基因编辑系统共递送的仿生纳米平台,实现化学动力学治疗与免疫治疗的联合治疗(图1)。研究团队利用PEG修饰的PEI稳定MnO2形成PEI-PEG@MnO2(PPM)载体,随后通过静电吸附负载CRISPR/Cas9-PD-L1构建PPMC复合物,最后包覆B16-F10癌细胞膜形成PPMC@CM仿生纳米颗粒。癌细胞膜仿生包被将赋予纳米颗粒同源靶向特性和免疫逃逸功能,显著提升了纳米颗粒的递送效率和肿瘤特异性富集能力。PPMC@CM进入细胞后,触发溶酶体逃逸释放CRISPR/Cas9-PD-L1,高效敲除PD-L1基因。此外,释放的MnO2缓解肿瘤缺氧,阻断缺氧-腺苷免疫抑制通路,同时消耗肿瘤微环境中过量GSH以增强Mn2+介导的化学动力学治疗效果,并实现肿瘤特异性T1加权MRI成像。PPMC@CM通过联合化学动力学-免疫治疗抑制肿瘤生长并实现MRI监测,为黑色素瘤的诊疗一体化提供了创新性策略。

图1. PPMC@CM的合成路线及其用于MRI引导的化学动力学/免疫治疗的机制示意图。
TEM和XPS结果证实PPM的成功合成,平均粒径为20.62 nm(图2A-C)。琼脂糖凝胶电泳实验表明当N/P比≥0.5时,PPM能够完全压缩Cas9-PD-L1(图2D)。绿色荧光蛋白转染实验表明,PPMC可以有效转染质粒,并且最佳N/P为15(图2E-G)。SDS-PAGE和TEM结果显示B16-F10细胞膜成功包覆,PPMC@CM的平均粒径为158.9 nm,细胞膜厚度约为12.2 nm(图2H-I)。
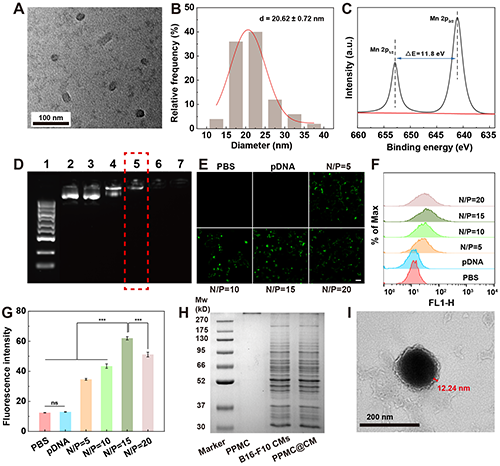
图2.(A)PPM的TEM图像及(B)粒径分布直方图。(C)PPM中Mn 2p轨道的XPS能谱。(D)不同N/P下Cas9-PD-L1与PPM的琼脂糖凝胶阻滞实验。泳道1:DNA Marker(100-5000 bp);泳道2:游离Cas9-PD-L1;泳道3-7:N/P分别为0.125、0.25、0.5、1和2。(E)通过共聚焦显微镜观察B16-F10细胞经PBS、pDNA及PPMC(N/P = 5、10、15和20)转染后的绿色荧光蛋白表达(比例尺:20 μM)。(F)B16-F10细胞经PBS、pDNA及PPMC(N/P = 5、10、15和20)转染后的流式细胞术图及(G)相对定量结果。(H)PPMC@CM的SDS-PAGE结果分析。(I)PPMC@CM的TEM图像。
研究团队系统评估了材料的·OH/O2生成能力及MR成像性能。MB降解实验表明,PPM在模拟TME条件下展现出优异的·OH生成性能(图3A)。PPMC@CM能有效催化H2O2分解产氧(图3B),并实现Mn2+的响应性释放(图3C)。核磁共振分析证实,该材料具有GSH响应特性,可释放Mn2+用于T1加权MR成像(图3C-D)。此外,PPMC@CM表现出良好的血液相容性(图3F),证实其具备安全可靠的生物医学应用潜力,为后续体内实验奠定了基础。
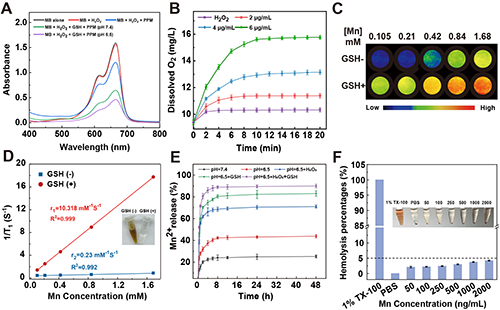
图3.(A)PPM在不同条件下与MB 反应后的UV-vis谱图([MB] = 10 μg/mL,[NaHCO3] = 25 mM,[H2O2] = 10 mM,[Mn] = 0.1mM)。(B)不同浓度材料分散体系中H2O2分解的O2浓度随时间变化曲线([H2O2] = 10 mM)。(C)PPMC@CM在不同Mn浓度及GSH(10 mM)存在与否条件下的伪彩色磁共振成像图和(D)1/T1值与Mn浓度之间的线性拟合关系。(E)PPMC@CM在不同环境条件下Mn2+的累积释放动力学曲线。(F)CPL@G5-BS在有无激光照射下652 nm处的紫外吸收强度对比。
研究团队选用B16-F10细胞进行体外实验评价。细胞毒性分析表明,PPMC@CM具有最优的肿瘤细胞杀伤效果(图4A)。细胞摄取实验证实CM包覆显著增强了材料的靶向摄取能力并赋予其免疫逃逸特性(图4B-D)。通过溶酶体共定位及Western blot分析发现,PPMC@CM在4小时内被内化进入溶酶体,8小时后成功逃逸并进入细胞核,实现PD-L1基因敲除(图4E-G)。
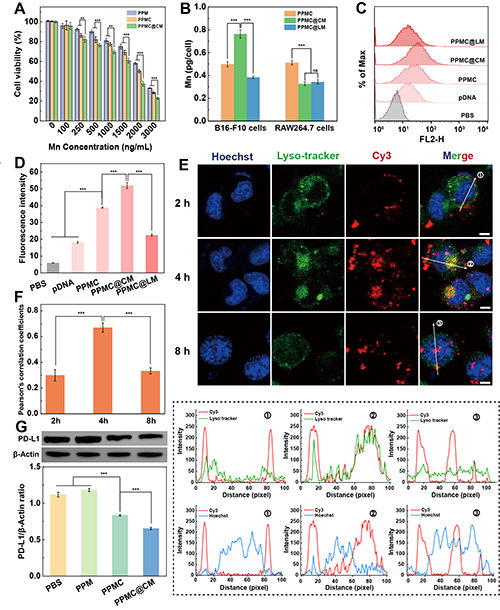
图4.(A)不同材料对B16-F10细胞的细胞毒性评估。(B)B16-F10细胞或RAW264.7细胞与不同材料共孵育后细胞内的Mn含量。(C)B16-F10细胞与不同材料共孵育6小时后的流式细胞术分析图及(D)平均荧光强度的。(E)PPMC@CM(Cy3标记Cas9-PD-L1)与B16-F10细胞共孵育2、4、8小时的共聚焦显微镜图像及(F)相应的共定位荧光强度分析。比例尺: 10 μm。(G)Western blot检测与不同材料共孵育后细胞PD-L1蛋白的表达水平及相应的定量分析结果。
接下来,研究团队探究了PPMC@CM如何调节B16-F10细胞中的氧化应激。PPMC@CM组诱导了最显著的GSH耗竭、ROS产生和LPO积累(图5A-E)。进一步研究发现,PPMC@CM处理后的B16-F10细胞凋亡率显著增强(图5F-G)。
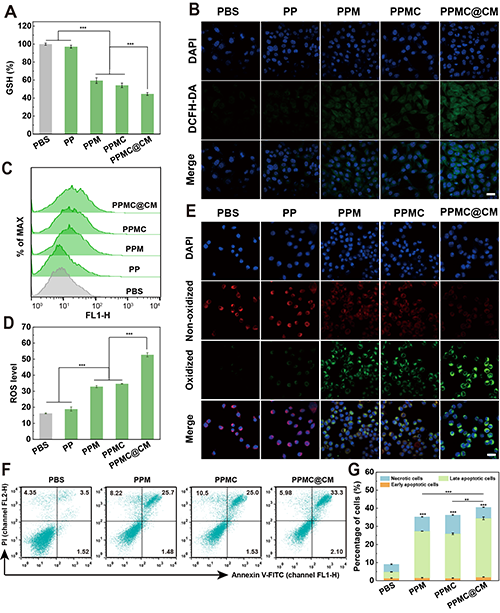
图5.(A)不同处理6小时后B16-F10细胞内GSH的相对水平。(B)激光共聚焦显微镜观察B16-F10细胞与不同材料共孵育6小时后细胞内ROS水平。比例尺:20 μm。(C)流式细胞仪分析B16-F10细胞经不同处理6小时后的细胞内ROS水平和(D)定量分析。(E)通过CLSM观察不同处理6小时后B16-F10细胞中LPO的表达水平。(F)流式细胞术分析及(G)定量统计B16-F10细胞经不同处理24小时后早期凋亡、晚期凋亡及坏死细胞的比例。
团队进一步评估了PPMC@CM对缺氧-腺苷轴的抑制作用。结果表明,PPMC@CM组显著缓解了肿瘤细胞的缺氧状态(图6A),并明显降低了HIF-1α的表达水平(图6B)。通过WB实验和ELISA检测进一步证实,PPMC@CM能够有效抑制CD39/CD73的表达及ADO的生成(图6C-E)。综上,PPMC@CM通过改善细胞内缺氧微环境,显著抑制了缺氧-腺苷信号轴的激活,从而降低细胞外腺苷的水平(图6F)。
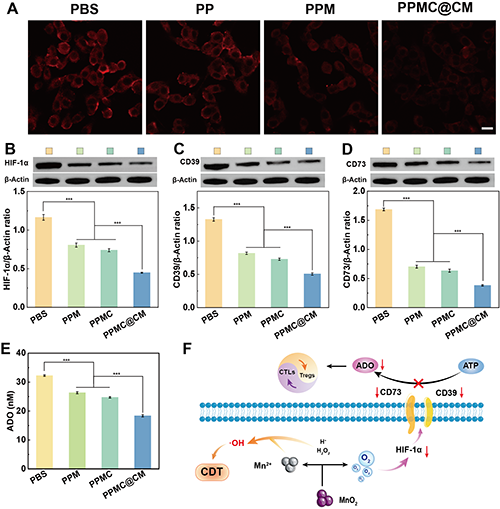
图6.(A)使用[Ru(dpp)3]Cl2探针检测不同处理后B16-F10细胞中的O2含量,比例尺:20 μm。缺氧条件下,B16-F10细胞经不同材料处理后(B)HIF-1α、(C)CD39和(D)CD73蛋白表达的Western blot分析及定量数据。(E)缺氧条件下,不同材料处理的B16-F10细胞中ADO水平。(F)PPMC@CM的抗肿瘤机制。
研究团队通过建立B16-F10肿瘤模型,评估了PPMC@CM在活体内的MR成像性能。结果显示,给药后两组肿瘤部位的MR信号强度均迅速升高,并在0.5小时达到峰值后逐渐衰减,其中PPMC@CM组的信号强度显著高于PPMC组(图7A-B)。进一步分析PPMC@CM在体内的生物分布发现,注射0.5小时后,Mn元素在肿瘤组织中的蓄积量达到最高,随后逐渐被代谢清除(图7C-D)。
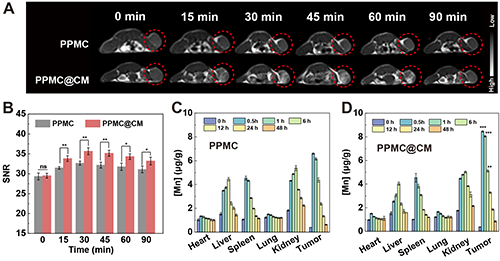
图7.(A)瘤周注射PPMC或PPMC@CM后不同时间点肿瘤体内T1加权MR成像图及(B)肿瘤部位MR信噪比定量分析。不同时间点通过瘤周注射(C)PPMC和(D)PPMC@CM后,小鼠主要器官和肿瘤中的Mn元素含量。
研究团队系统评估了PPMC@CM对B16-F10荷瘤小鼠的抗肿瘤疗效。结果显示,治疗期间各组小鼠体重无明显变化,表明实验材料均未表现出明显毒性(图8A-B)。PPMC@CM治疗组表现出最优异的抗肿瘤效果,其肿瘤体积和重量均显著低于其他组(图8C-E)。进一步通过组织病理学分析(H&E、TUNEL和Ki67)证实,PPMC@CM能显著诱导肿瘤组织坏死和细胞凋亡,同时有效抑制肿瘤细胞增殖(图8F)。
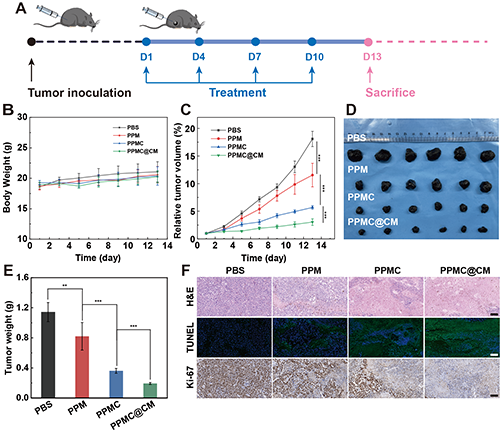
图8.(A)B16-F10小鼠肿瘤模型建立及抗肿瘤治疗方案的示意图。治疗期间B16-F10荷瘤小鼠的(B)体重以及(C)肿瘤相对体积变化。(D)末次给药后剥离肿瘤的实物照片和(E)剥离肿瘤的重量统计。(F)第13天B16-F10肿瘤组织的H&E、TUNEL和Ki-67染色。比例尺:20 μm。
最后,研究团队深入探究了PPMC@CM的抗肿瘤作用机制。免疫荧光染色与ELISA检测结果显示,PPMC@CM治疗组肿瘤组织中PD-L1、HIF-1α、CD39及CD73的表达水平均显著下调(图9A-E)。同时,肿瘤部位的CD4+和CD8+T细胞的浸润数量明显增加(图9G-I)。
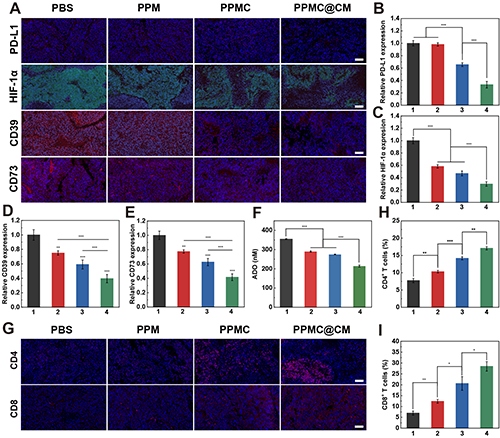
图9.(A)B16-F10肿瘤切片中PD-L1、HIF-1α、CD39和CD73的免疫荧光染色。比例尺:20 μm。不同治疗组B16-F10肿瘤组织中(B)PD-L1、(C)HIF-1α、(D)CD39和(E)CD73在的表达定量分析(1:PBS;2:PPM;3:PPMC;4:PPMC@CM)。(F)不同治疗组血清中ADO的含量。(G)不同治疗组B16-F10肿瘤切片中CD4和CD8的免疫荧光染色。比例尺:20 μm。不同治疗组B16-F10肿瘤切片中(H)CD4+ T细胞和(I)CD8+ T细胞数量定量分析。
PPMC@CM可显著促进脾脏中CD4+和CD8+ T细胞的增殖活化(图10A-E),降低调节性T细胞(Tregs)的比例,并显著提升血清中促炎细胞因子TNF-α、IFN-γ和IL-6的表达水平(图10F-H)。
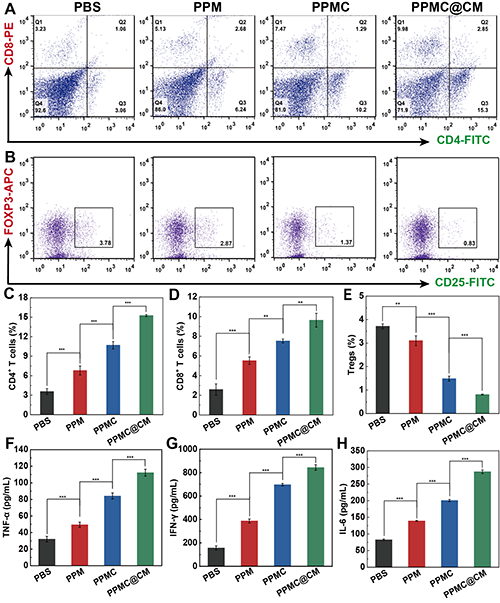
图10. 对不同处理后荷瘤小鼠脾脏(A)CD4+/CD8+ T细胞和(B)Tregs进行流式细胞术分析。(C)CD4+、(D)CD8+ T细胞比例和(E)Tregs比例的相应定量。不同组小鼠治疗13天后血清中(F)TNF-α、(G)IFN-γ和(H)IL-6水平。
简而言之,团队所构建的PPMC@CM纳米平台通过同源靶向作用在肿瘤部位高效富集,释放的MnO2可产生氧气缓解肿瘤缺氧,同时消耗GSH以增强Mn2+介导的类芬顿反应,从而显著提升CDT疗效并实现肿瘤靶向MRI成像。此外,CRISPR/Cas9系统有效敲除PD-L1基因,同时肿瘤缺氧的改善能抑制免疫抑制性的缺氧-腺苷能轴,进一步增强免疫治疗效果,激活强大的抗肿瘤免疫反应。本研究将CRISPR/Cas9-PD-L1系统与缺氧-腺苷轴抑制策略相结合,为设计黑色素瘤诊疗一体化的仿生纳米平台提供了新思路。
以上研究成果以“A Biomimetic Nanoplatform Mediates Hypoxia-Adenosine Axis Disruption and PD-L1 Knockout for Enhanced MRI-Guided Chemodynamic-Immunotherapy”为题,在线发表于国际著名期刊 Acta Biomaterialia (DOI: 10.1016/j.actbio.2025.06.021 )。东华大学生物与医学工程学院郭睿教授与史向阳教授为共同通讯作者,东华大学硕士研究生孙梦宇为第一作者。该工作得到了国家自然科学基金、上海市科学技术委员会等的资助。
文章链接:https://doi.org/10.1016/j.actbio.2025.06.021
- 东华大学沈明武研究员/史向阳教授团队:铜掺杂层状双金属氢氧化物共递送蛋白/药物调控肿瘤双重代谢实现级联的化学动力学/免疫治疗 2025-02-08
- 东华大学史向阳教授团队 AFM:微流控合成无载体全活性的金属酚纳米胶囊用于肿瘤的化疗-化学动力学治疗-免疫治疗 2024-12-02
- 东华大学史向阳/沈明武团队 Acta Biomater.:仿生含铜纳米凝胶用于磁共振成像引导的肿瘤化疗-化学动力学治疗-免疫治疗 2024-10-03
- 天工大高辉/余云健团队 ACS Nano:创新纳米酶精准消除肿瘤胞内菌 助力结直肠癌免疫治疗突破 2026-02-20
- 山东大学崔基炜教授团队《Adv. Mater.》:“以瘤治瘤”的水凝胶疫苗 - 实现个性化肿瘤免疫治疗新突破 2025-10-09
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
