代谢重编程是癌症的重要特征之一。肿瘤细胞的特定代谢途径及其在肿瘤微环境(TME)中积累的代谢产物大大限制了效应T细胞对肿瘤细胞的免疫监视和杀伤能力。靶向TME改变肿瘤代谢途径被认为是下一代癌症治疗的理想策略。研究表明,TME中乳酸的积累不仅促进了肿瘤的生长、侵袭和转移,还削弱了效应T细胞和自然杀伤细胞的功能,并促进了巨噬细胞的M2型免疫抑制表型转化,从而建立了免疫抑制微环境。令人鼓舞的是,已被开发的调节乳酸代谢策略,能够逆转免疫抑制微环境,激活免疫系统。
纳米递送系统为改善蛋白质和小分子药物的递送效率提供了一种新的策略,在改变肿瘤和免疫细胞的代谢途径方面展示出良好的应用潜力。研究显示,通过纳米载体递送乳酸氧化酶(LOX)或乳酸外排抑制剂来调节乳酸代谢,并结合声动力治疗、光热治疗或化疗等策略显示出良好的抗肿瘤效果。相关研究显示乳酸作为关键代谢靶点,为激活免疫治疗提供了一种新的可行策略。然而,当前的乳酸代谢治疗策略主要集中在减少乳酸含量,设计能够同时耗竭TME中乳酸并利用其降解产物过氧化氢(H2O2)增强肿瘤治疗的纳米药物可大大提高肿瘤治疗效果。此外,由于肿瘤细胞的代谢具有高度的可塑性,将乳酸代谢调节与其他代谢途径结合起来靶向多条代谢途径有望实现更高效的代谢调控治疗。
肿瘤细胞的氧化还原代谢被认为是肿瘤治疗的一个有效靶点。基于金属离子介导的芬顿或类芬顿反应的化学动力学治疗(CDT)是调节肿瘤氧化还原代谢平衡实现肿瘤治疗的典型代表。其原理是通过将H2O2转化为更具毒性的羟基自由基(?OH),从而诱导肿瘤细胞凋亡。尽管CDT具有良好的应用潜力,但是肿瘤内低浓度的H2O2限制了?OH的持续产生。另外,细胞内高水平的还原性物质谷胱甘肽(GSH)则会捕捉生成的?OH,限制了CDT的治疗效果。因此,构建能够提高H2O2含量并降低GSH水平的纳米药物是提高CDT效率的关键。层状双金属氢氧化物(LDH)是一种典型的二维无机纳米材料,具有合成简便、易于掺杂二价和三价金属离子、对pH敏感和良好的生物相容性等特点,在肿瘤的诊断及治疗领域显示出良好的转化潜力。
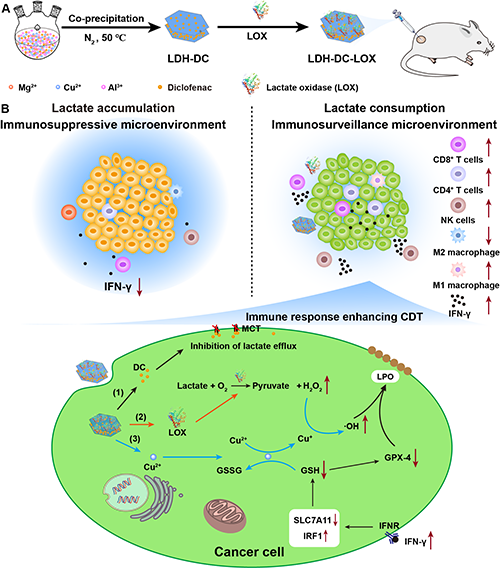
图1、LDH-DC-LOX纳米颗粒的制备及其用于调节乳酸和氧化还原代谢诱导级联的化学动力学/免疫疗法。
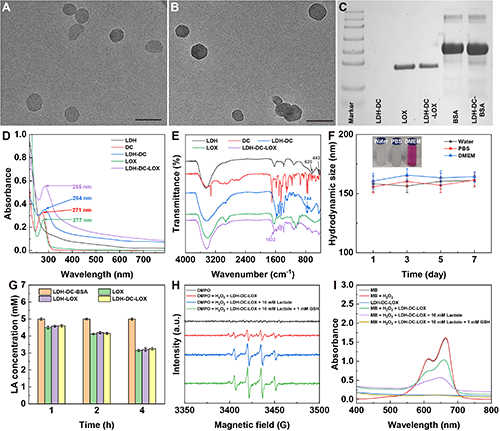
图2、(A)LDH和(B)LDH-DC纳米颗粒的透射电子显微镜(TEM)图像(标尺:100 μm)。(C)LDH-DC、LOX、LDH-DC-LOX、BSA、LDH-DC-BSA的SDS-PAGE蛋白分析。LDH、DC、LDH-DC、LOX、LDH-DC-LOX的(D)紫外光谱和(E)红外光谱。(F)LDH-DC-LOX在不同分散剂中的水合粒径变化。(G)LDH-DC-LOX的乳酸降解能力。(H)LDH-DC-LOX在不同溶液中的电子自旋共振(ESR)图谱。(I)LDH-DC-LOX与亚甲基蓝(MB)溶液反应后的紫外吸收光谱。
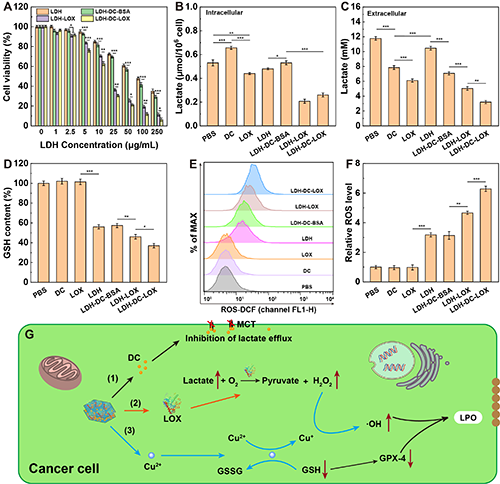
图3、(A)不同浓度LDH、LDH-DC-BSA、LDH-LOX或LDH-DC-LOX处理4T1细胞24小时的细胞活力(n = 6)。4T1细胞经不同处理12 h(B)细胞内和(C)细胞外的乳酸含量(n = 3)。4T1细胞经不同处理6 h细胞内的(D)GSH含量及(E和F)ROS含量(n = 3)。(G)LDH-DC-LOX改变肿瘤细胞内氧化还原平衡增加ROS含量示意图。图(A-D,F)中,*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
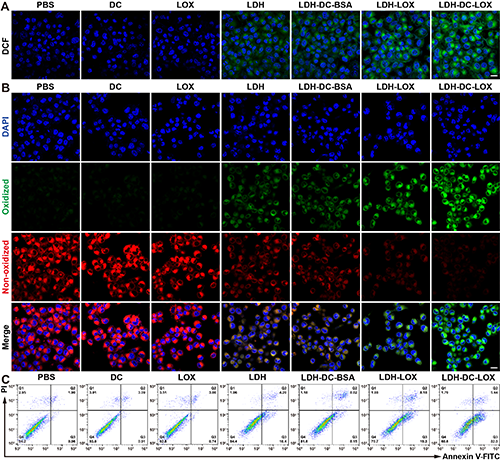
图4、4T1细胞经不同处理6 h的(A)ROS含量检测及(B)脂质过氧化物(LPO)含量检测的激光共聚焦图片(标尺:20 μm)。(C)4T1细胞经不同处理24 h凋亡检测的流式细胞术点图(n = 3)。
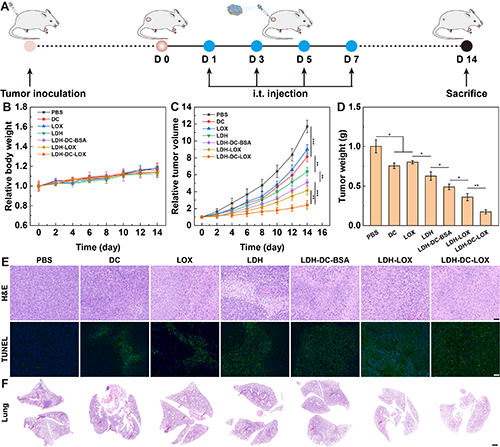
图5、(A)小鼠4T1肿瘤建立和抗肿瘤实验评价流程示意图。(B)荷瘤小鼠经不同治疗后的(B)相对体重变化(n = 5)、(C)相对肿瘤体积变化(n = 5)、(D)肿瘤体积变化(n = 5)。(E)各实验组小鼠肿瘤切片的H&E及TUNEL染色图片(标尺:50 μm)。(F)各实验组小鼠肺组织切片的H&E染色图片(标尺:1 mm)。图(C-D)中,*表示p < 0.05,**表示p < 0.01,***表示p < 0.001。
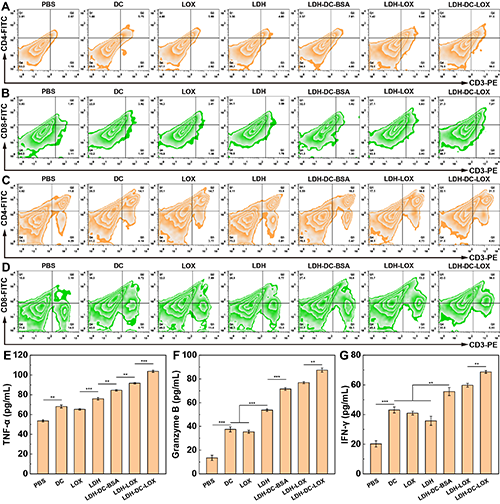
图6、不同实验组小鼠肿瘤中(A)CD 4+ T细胞和(B)CD 8+ T细胞的流式细胞术点图。不同实验组小鼠脾脏中(C)CD 4+ T细胞和(D)CD 8+ T细胞的流式细胞术点图。各实验组小鼠血清中(E)TNF-α、(F)Granzyme-B 和(F)IFN-γ的ELISA检测结果(n = 3)。图(E-G)中, **表示p < 0.01,***表示p < 0.001。
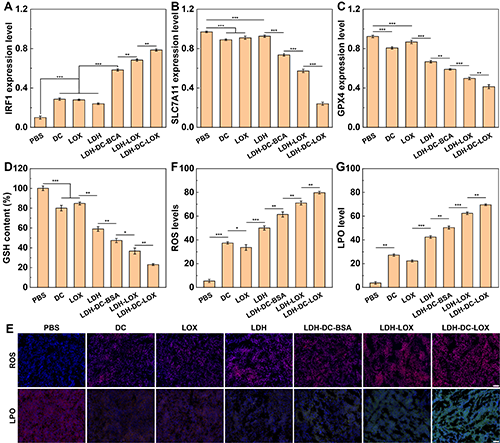
图7、不同实验组小鼠肿瘤中(A) IRF1、(B)SLC7A11、(C)GPX4蛋白表达水平的定量结果图。(D)不同实验组小鼠肿瘤肿GSH含量。不同实验组小鼠肿瘤的(E和F)ROS和(E和G)LPO荧光图像及其定量分析。
综上所述,本研究设计的LDH-DC-LOX纳米药物具有以下显著特点:(1)Cu2+、DC、LOX可在酸性TME条件下从纳米平台中释放;(2)DC和LOX的联合作用可有效调节乳酸代谢,减少TME中的乳酸,从而激活免疫治疗,并生成H2O2;(3)掺杂的Cu2+能够有效调节肿瘤细胞的氧化还原代谢,通过类芬顿反应将H2O2转化为更具毒性的?OH,且通过消耗细胞内的GSH增强CDT;(4)LOX催化乳酸产生的H2O2和由免疫应答激活后分泌的细胞因子IFN-γ可进一步增强CDT效果。因此,本研究所设计的LDH-DC-LOX纳米药物能够有效地调节乳酸和氧化还原双重代谢途径,通过级联作用激活免疫治疗并增强CDT,为靶向代谢调控治疗肿瘤提供了新的策略。
文章链接:https://doi.org/10.1016/j.actbio.2025.02.008
- 华东理工刘润辉教授课题组《Nat. Biotechnol.》:基于宿主防御肽模拟物组装体的共递送组合体内协同治疗耐药真菌感染 2026-01-02
- 浙江大学周民团队《Cell》子刊:“药食同源”微藻-黄芪多糖系统减少免疫治疗不良事件并增强疗效 2025-08-26
- 东华大学史向阳教授团队 JCIS:电喷雾制备核壳微球共递送纤连蛋白与白藜芦醇协同治疗急性肺损伤 2025-02-04
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
- 东华大学郭睿教授/史向阳教授课题组 Acta Biomater.:仿生纳米平台介导的缺氧-腺苷轴破坏和PD-L1敲除用于增强MRI引导的化学动力学/免疫治疗 2025-06-27
