糖尿病慢性伤口因高血糖诱导的线粒体功能障碍、巨噬细胞极化失衡和血管内皮损伤而难以愈合。传统疗法(如清创术或生长因子局部应用)效果有限,且无法解决线粒体动态失衡与免疫代谢交互失调的核心问题。该研究聚焦于糖尿病慢性伤口愈合难题,开发了一种丝素蛋白/明胶(SG)基生物水凝胶并负载线粒体分裂抑制剂Mdivi-1(SG/M),系统探究其促进伤口愈合的效果与机制。糖尿病慢性伤口因代谢紊乱、免疫失调和微血管损伤导致愈合困难,而线粒体动力学失衡被证实与糖尿病并发症密切相关。Mdivi-1作为Drp1抑制剂,可抑制线粒体裂变、减轻氧化应激和炎症反应。研究通过溶液共混和交联工艺制备SG/M水凝胶,其具有三维多孔结构、适宜的机械强度和缓释能力,能持续释放Mdivi-1并维持局部治疗浓度。在糖尿病大鼠模型中,SG/M水凝胶显著加速伤口闭合,促进上皮再生和胶原纤维有序沉积,减少炎症细胞浸润,同时上调血管内皮生长因子(VEGFα)表达以增强血管新生。体外实验表明,高葡萄糖环境可诱导巨噬细胞向促炎的M1表型极化,伴随线粒体碎片化和糖酵解代谢增强,而Mdivi-1干预可逆转这一过程,促进巨噬细胞向抗炎的M2表型极化,恢复线粒体融合状态并促进向氧化磷酸化代谢的转变。
机制研究揭示,Mdivi-1通过激活MEK/ERK信号通路驱动巨噬细胞代谢重编程,进而促进M2极化。更重要的是,Mdivi-1处理的M2型巨噬细胞可通过细胞间线粒体转移,将功能性线粒体传递给血管内皮细胞(HUVECs),改善后者在高糖环境下的线粒体膜电位、减少活性氧(ROS)积累,并增强其迁移和管腔形成能力。Transwell共培养实验证实,线粒体转移依赖于巨噬细胞的极化状态,M2型巨噬细胞传递的线粒体可整合到HUVECs的线粒体网络中,恢复其能量代谢功能。此外,SG/M水凝胶的生物相容性良好,系统毒性低,其多孔结构促进细胞黏附与营养交换,为组织修复提供了理想微环境。该研究不仅阐明了Mdivi-1通过“巨噬细胞极化-线粒体转移”轴改善糖尿病微环境的新机制,也为糖尿病伤口治疗提供了兼具抗炎和促血管生成功能的新型生物材料策略,展现了靶向线粒体动态调控在代谢性疾病并发症中的临床转化潜力。
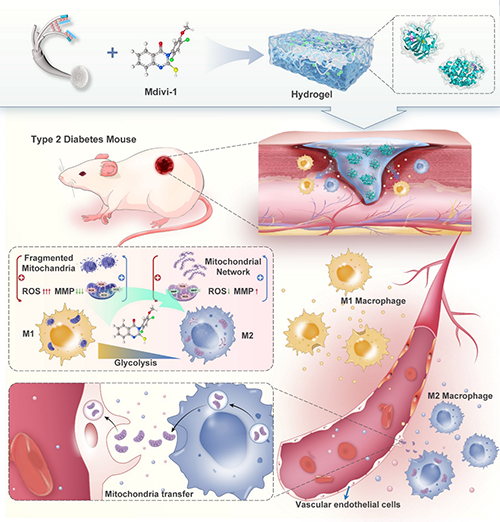
图1. SG/M 水凝胶的制备及其在慢性糖尿病伤口中的作用及机制示意图。
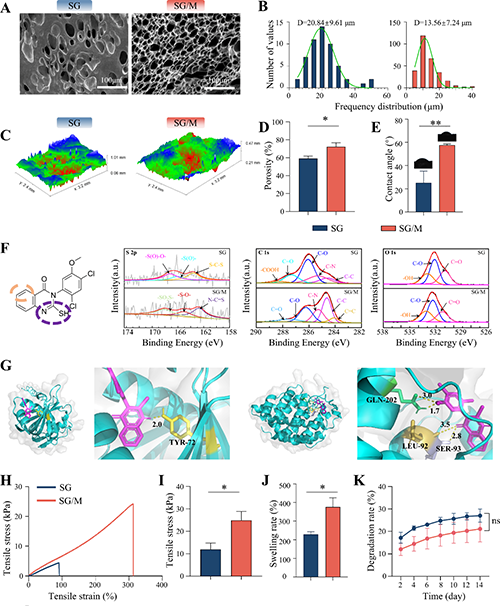
图2. SG/M水凝胶的结构表征。
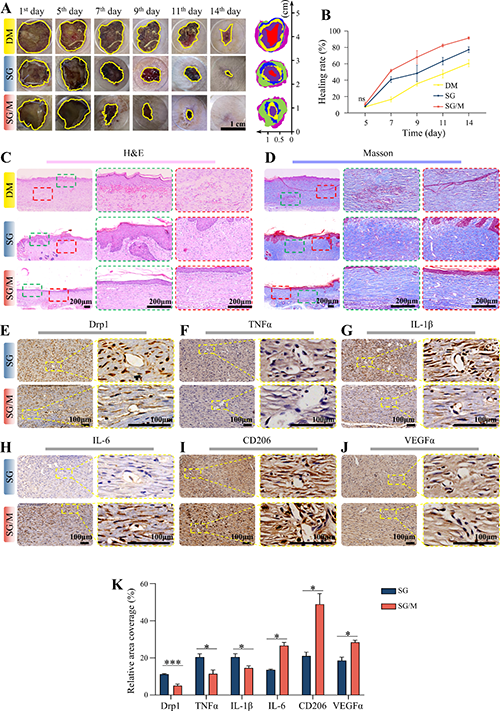
图3. SG/M水凝胶促进糖尿病大鼠皮肤伤口愈合。
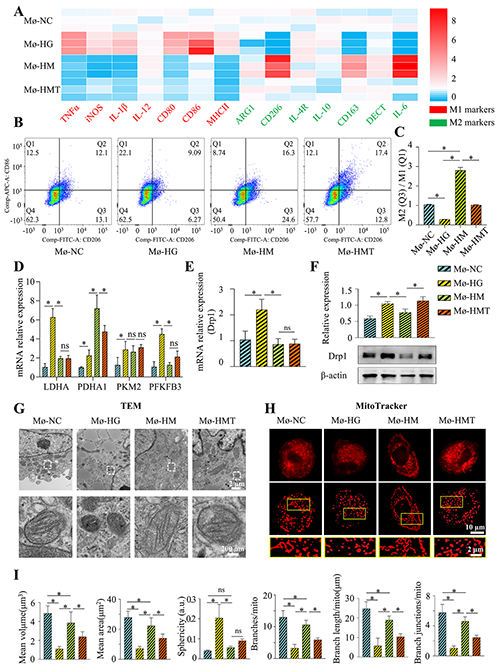
图4. 体外巨噬细胞极化及线粒体动力学分析。
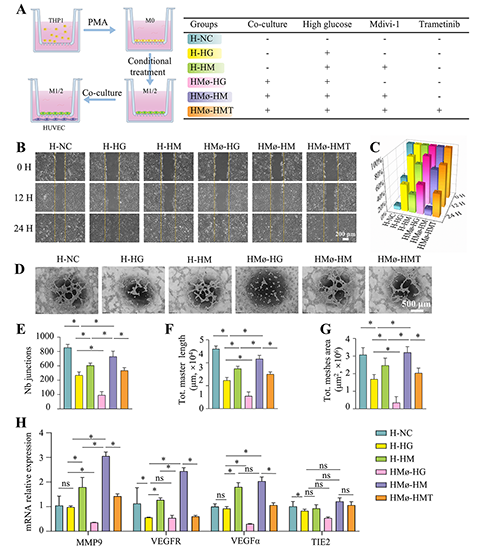
图5. 体外血管内皮细胞的迁徙行为及成管功能分析。
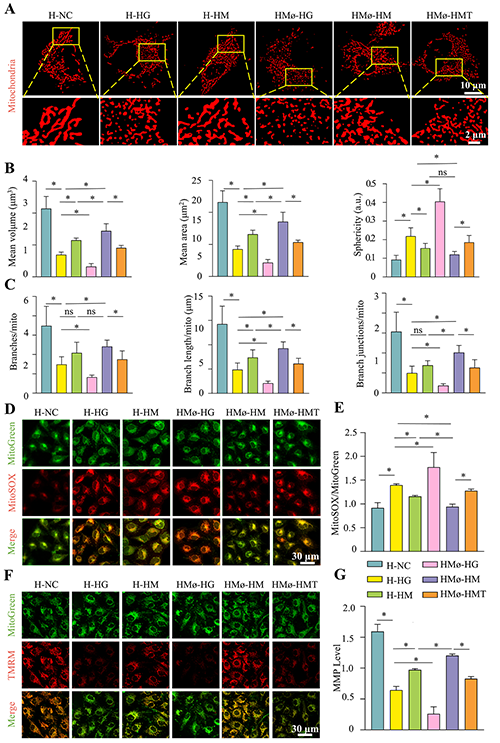
图6. 体外血管内皮细胞的线粒体功能分析。
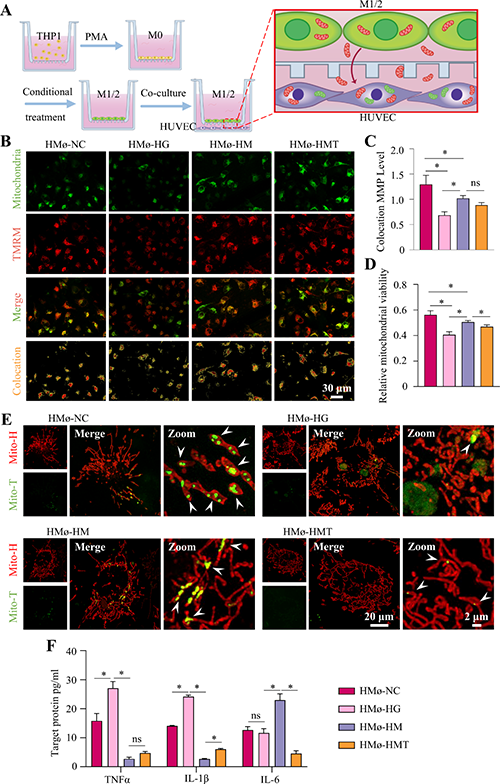
图7. 巨噬细胞向血管内皮细胞的线粒体转移。
该工作以“2A-biohydrogels accelerate diabetic wound healing by promoting M2
macrophage polarization and functionalized mitochondrial transfer to endothelial cells”为题发表于Chemical Engineering Journal(2025:514 ,163130)期刊上(2023 IF=13.4)。文章第一作者为四川大学华西口腔医学院王浩博士和周敏硕士,通讯作者为四川大学华西口腔医学院甘雪琦教授。该项研究得到了国家自然科学基金面上项目的支持。
论文链接:https://doi.org/10.1016/j.cej.2025.163130
