骨质疏松性骨折由于持续的炎症激活、破骨细胞过度活跃、成骨分化能力受损以及血管生成潜力下降,与正常骨折相比愈合更加缓慢且困难。全身给药存在生物利用度低、副作用大等问题,而局部递送药物以促进免疫调节、增强成骨分化并抑制破骨细胞活性,成为修复骨质疏松性骨折的有前景策略。
近日,山东大学崔基炜教授联合齐鲁医院刘新宇教授和中科院兰州化学物理研究所胡徐智研究员开发了一种基于聚乙二醇(PEG)-阿仑膦酸(ALN)-镁离子(Mg2+)的双重交联水凝胶(PAMg),用于骨质疏松性骨缺损修复(图1)。
2025年11月10日,相关研究成果以“Engineered Poly(ethylene glycol)-Alendronate-Magnesium Hydrogels Potentiate Site-specific Immunomodulation for the Healing of Osteoporosis Fractures”为题发表在《Advanced Functional Materials》上。山东大学齐鲁医院博士后尤云昊和山东大学化学与化工学院博士生魏绍银为该论文的共同第一作者。

图1.(a)PAMg水凝胶的制备过程示意图。(b)PAMg水凝胶通过释放ALN和Mg2+抑制破骨细胞、促进成骨、血管生成和免疫调节的作用机制。
该研究的创新之处在于:(1)双重交联协同增效:通过酰胺键形成和金属配位协同作用,将ALN接枝的8-arm-PEG-NHS与镁离子及8-arm-PEG-NH2混合形成水凝胶。这种可逆交联策略不仅有利于水凝胶形成,还能够在降解过程中持续释放ALN和Mg2+,有效结合了ALN和Mg2+的功能。(2)多重机制促进骨修复:释放的Mg2+直接刺激局部细胞(成骨细胞和内皮细胞)的活化与分化,协助骨重建;同时促进巨噬细胞从M1向M2表型极化,建立良好的骨免疫微环境;ALN则有效抑制骨质疏松条件下破骨细胞的过度活性。(3)长效缓释与力学性能优化:水凝胶在体内可持续释放ALN和Mg2+超过25天,且具有优异的力学性能(压缩断裂强度约340 kPa,拉伸强度约81 kPa),能够维持凝胶的结构完整性。这项研究通过免疫调节和骨诱导活性的双重调控,为骨质疏松性骨缺损的修复提供了创新性治疗策略。
该研究的论证层层递进,通过系统的体内外实验完整地揭示了PAMg水凝胶的作用机制,其核心内容和文章思路可通过以下流程图展现:
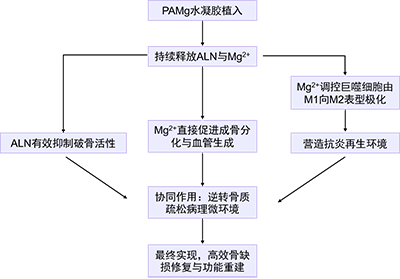
研究团队通过系统的实验数据,全面论证了PAMg水凝胶的优异特性及其促进骨修复的多重机制(图2-6)。研究首先证实了基于酰胺键和金属配位双重交联的PAMg水凝胶具备稳定的三维多孔结构、优异的力学性能(压缩强度~340 kPa,拉伸强度~81 kPa)以及可持续释放ALN和Mg2+超过25天的能力(图2)。体外实验进一步揭示,该水凝胶能直接促进骨髓间充质干细胞的成骨分化(ALP活性、钙结节形成及成骨标志物表达上调)和人脐静脉内皮细胞的血管生成(管腔形成与迁移能力增强),同时有效抑制破骨细胞的形成及相关基因表达(图3-4)。其核心机制在于,团队证实Mg2+的释放可显著调控巨噬细胞极化,促使促炎的M1表型向抗炎再生的M2表型转变,并由此营造的有利微环境能间接强力协同促进成骨和血管生成(图5-6)。最终,在大鼠骨质疏松性颅骨缺损模型中,团队证实PAMg水凝胶治疗显著促进了新骨生成(Micro-CT显示骨体积分数、骨密度等指标最优)和质量修复,其体内免疫调控(M2巨噬细胞增多)、成骨活性和血管生成能力(相关标志物表达增强)同步提升的作用机制得到了验证(图7-8)。

图2. PAMg水凝胶的制备与理化表征。(a)水凝胶形成示意图。(b)不同水凝胶的宏观照片。(c)截面SEM图像。(d)应变依赖流变行为。(e-g)压缩应力-应变曲线及定量分析。(h)拉伸应力-应变曲线。(i)FTIR光谱。(j)XPS P1s谱图。(k-m)体内降解行为。(n)ALN和Mg2+的体外释放曲线。

图3. PAMg水凝胶调控BMMSCs成骨分化的体外行为。(a)成骨相关基因mRNA表达。(b,c)ALP染色及定量结果。(d,e)茜素红S染色及定量结果。(f,g)成骨相关蛋白表达及定量。(h,i)OPN免疫荧光染色及定量。(j)Mg2+促进成骨作用示意图。

图4. PAMg水凝胶调控破骨细胞分化及HUVECs血管生成的体外研究。(a)血管相关基因mRNA表达水平。(b,c)血管相关蛋白表达水平及定量分析结果(n = 4)。(d,e)不同处理条件下HUVECs的血管生成能力及定量分析结果。(f,g)划痕愈合实验及定量分析结果。(h)PAMg水凝胶中Mg2+促进血管生成的作用机制示意图。(i,j)TRAP染色图像及定量分析结果。(k)破骨相关基因mRNA表达水平。(l)破骨相关蛋白表达水平。(m)PAMg水凝胶中ALN抑制破骨细胞的作用机制示意图。

图5. PAMg水凝胶调控巨噬细胞免疫反应的体外研究。(a)不同处理后RAW 264.7细胞中IL-1β、TNF-α、IL-6、IL-4和IL-10的mRNA表达水平。(b)不同处理后RAW 264.7细胞中CD206、iNOS和ARG1的蛋白表达水平。(c,d)巨噬细胞极化表型及定量结果。(e)促炎细胞因子IL-1β、TNF-α、IL-6、IL-4和IL-10的ELISA分析。(f,g)iNOS的免疫荧光染色图像及相对平均荧光强度(MFI)定量分析结果。(h)PAMg水凝胶中Mg2?调控免疫反应的机制示意图。

图6. 通过巨噬细胞极化调控成骨和血管生成的体外研究。(a)巨噬细胞细胞因子mRNA表达水平。(b)实验设计示意图。(c)成骨相关基因表达水平。(d)成骨相关蛋白表达水平。(e,f)ALP和茜素红S染色及定量分析结果。(g,h)血管形成能力及定量分析结果。(i)划痕实验显示HUVECs迁移能力。(j)血管相关蛋白表达水平。(k)Mg2+通过免疫调节调控成骨和血管生成机制示意图。

图7. 水凝胶调控骨质疏松骨愈合的体内评价。(a)动物模型构建及相关评价示意图。(b)移植后0、4和8周的三维Micro-CT图像。(c)第4和第8周Micro-CT定量分析。(d)第8周缺损区域H&E和Masson染色。

图8. 水凝胶对骨质疏松性骨缺损中免疫反应、成骨及血管生成的调控评估。(a,b)缺损区域内iNOS与ARG1的免疫荧光染色及定量结果;(c)BMP2与(d)CD31的免疫荧光染色图。(e)RUNX2与(f)VEGFA的免疫组化染色图。(g-j)BMP2、RUNX2、CD31及VEGFA的定量分析结果。
本研究开发了一种兼具免疫调节与成骨诱导活性的双交联水凝胶,用于修复骨质疏松性骨缺损。PAMg水凝胶可实现功能性金属离子与ALN的持续释放。释放的Mg2+直接刺激局部细胞的激活与分化,从而促进骨重建。此外,Mg2+促进巨噬细胞极化从M1型向M2型转变,从而建立有利的骨免疫微环境。这种转变间接增强了骨髓间充质干细胞的成骨分化能力,促进血管生成,同时抑制破骨细胞分化。ALN的释放不仅抑制了骨质疏松状态下破骨细胞的过度活性,还减轻了破骨细胞诱导的巨噬细胞极化。总体而言,PAMg水凝胶构建了促进骨再生与整合的免疫调节微环境,直接调控局部骨血管形成,显著提升骨缺损部位的修复效能。该功能性PAMg水凝胶为免疫反应性与成骨诱导性骨组织工程材料开辟了新方向。上述研究工作得到国家自然科学基金与国家重点研发计划等项目的资助和支持。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202522720
- 浙大郑强/太原理工朱凤博团队 CEJ:碱激发粉煤灰催化的强韧复合水凝胶的可持续与规模化制备及其应用 2026-02-28
- 哈工大冷劲松教授团队与合作者 Compos. Part A:具有微电流刺激功能的碳纳米管复合水凝胶用于骨再生 2025-08-10
- 南科大刘吉团队 AFM:仿生矿化微球增韧抗冲击纳米复合水凝胶 2025-07-31
- 空军军医大学牛丽娜教授团队 ACHM:仿生结构协同免疫调控的DNA-胶原敷料实现烧伤无瘢痕再生? 2025-08-19
- 吉林大学刘镇宁教授/王冰迪博士团队 Adv. Sci.:亚精胺功能化可注射水凝胶减轻炎症反应,促进急性和糖尿病伤口愈合 2024-04-17
- 弗莱堡大学Prasad Shastri实验室《Adv.Sci》综述:连接3D生物打印和临床转化的生物桥梁 2021-12-08
- 山东大学崔基炜/王连雷教授《ACS Nano》:骨“创可贴”用于骨质疏松性骨折修复 2025-12-07
