为此,天津工业大学高辉教授团队以天然抗菌脂肪酸月桂酸为切入点,构建脂质分子库,从12种脂质中筛选出S12(月桂酰胺衍生物),实现选择性杀伤Fn而不影响益生菌丁酸梭菌(Cb)。S12能够破坏Fn细胞膜磷脂层(外膜+内膜)的通透性,引发膜去极化(DiSC3-5检测)和内容物泄漏(PI染色),而对Cb的厚肽聚糖壁无损伤(SEM/CLSM验证)。S12自组装形成纳米级脂质外壳,使Cb在模拟胃酸、模拟肠液和小鼠体内肠道滞留中具有较好的递送效果。
在Fn加重DSS诱导的结肠炎模型中,Cb@S12治疗组小鼠的结肠长度趋近于健康组小鼠,和对照组小鼠有显著性区别。Cb@S12治疗组能够提高Cb的定殖和以及其分泌的丁酸盐增加,并选择性杀伤Fn降低病原体的含量,丰富了肠道菌群的多样性,进而促使炎症因子TNF-α、IL-6、IFN-γ水平下降,促进肠道黏膜的修复。此外,在Fn感染的CRC原位模型中,Cb@S12治疗组同样提高Cb的定殖和丁酸盐增加,并选择性杀伤Fn,丰富了肠道菌群,并进一步提高了肿瘤内CD8+ T细胞浸润水平,M1型巨噬细胞占比提升,IFN-γ水平升高,形成抗肿瘤免疫微环境,从而起到了对肿瘤的治疗效果。通过IVIS成像可以看出,Cb@S12治疗组小鼠的肿瘤明显减小。

图1. 本研究示意图:A) 从月桂酸(LA)及其衍生物脂质库中筛选出对具核梭杆菌(Fn)具有选择性抗菌活性,同时对益生菌丁酸梭菌(Cb)无害的脂质。B)口服递送经筛选的S12包被的益生菌Cb(Cb@S12),用于治疗小鼠中Fn相关的肠道疾病。Cb@S12通过增强Cb在胃肠道稳定性和肠道滞留能力,有效将Cb递送至肠道病变部位,并且S12壳体选择性杀灭病原菌Fn而不损害Cb的活性。具体来说,通过以下途径恢复Fn加重的DSS诱导急性结肠炎小鼠:炎症因子减少、结肠上皮屏障修复以及肠道微生物稳态维持。此外,Fn感染的结直肠癌原位肿瘤小鼠通过肠道菌群精准调控和激发抗肿瘤免疫反应(表现为CD4+ T细胞、CD8+ T细胞和M1型巨噬细胞增加)实现对肿瘤的生长抑制。
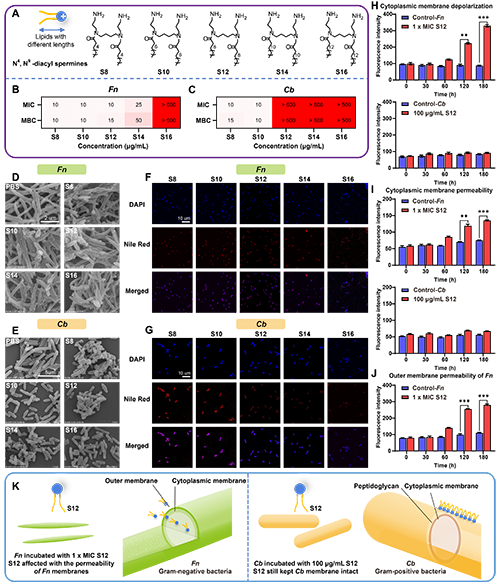
图2. 针对Fn选择性抗菌脂质的筛选及机制探索:A)脂质S8-S16的分子式。通过从12种化学结构多样的脂质库中筛选,发现月桂酰胺衍生物S12对Fn具有特异性抗菌活性。B, C) 脂质S8-S16对Fn(B)和Cb(C)的最低抑菌浓度(MIC)和最低杀菌浓度(MBC)列表。结果显示,S12对Fn的MIC为10 μg/mL,MBC为25 μg/mL,而对Cb无明显抑制作用。D-G)扫描电镜(SEM)和共聚焦显微镜(CLSM)观察细菌形态。 H-J)S12对细菌膜完整性的评估(n=3):H)胞质膜去极化:Fn经S12处理后DiSC3-5荧光信号显著增强(膜去极化),Cb无变化;I) 胞质膜通透性:Fn经S12处理后PI荧光信号显著增加(膜穿孔),Cb无变化;J) 外膜通透性:S12在MIC浓度下可破坏Fn外膜(NPN探针检测)。K) S12选择性抗菌机制示意图:S12通过靶向Fn较薄的革兰氏阴性外膜和内膜磷脂层,引发膜去极化、内容物泄漏及氧化损伤;而Cb因革兰氏阳性厚肽聚糖壁的保护,免受S12破坏。

图3. Cb@S12的配方设计及胃肠道稳定性与滞留增强机制:A)通过生物界面自组装策略构建Cb@S12。S12脂质通过静电吸附与益生菌表面结合,形成纳米保护层。B)Cb@S12双重功能:抵抗胃肠道恶劣环境并选择性杀灭Fn。C)测定Cb和Cb@S12的粒径分布与Zeta电位。D)流式细胞术分析FITC标记的Cb:未标记Cb作为对照。E-F)透射电镜(TEM)与扫描电镜(SEM)观察Cb@S12的微观形貌:TEM显示S12在Cb表面形成均匀纳米涂层;SEM显示Cb@S12表面光滑致密。G) 生长曲线显示Cb@S12在BHI培养基中37℃培养时的OD 600值,表明S12的壳体不影响益生菌增殖活性。H-I) 模拟胃液(SGF)耐受性测试:SEM显示Cb@S12在SGF中孵育0.5小时后仍保持完整结构。J-K) 模拟肠液(SIF)耐受性测试:SEM显示Cb@S12在SIF中孵育1小时和4小时后细菌结构稳定。L)模拟胃肠道消化后Cb与Cb@S12的活菌涂布平板验证。M)IVIS检测荧光标记的Cb@S12小鼠肠道滞留:口服相同数量(1×10? CFU)的Cb和Cb@S12后,Cb@S12在小鼠肠道内的滞留效果更好(n=3)。

图4. Cb@S12对Fn加重的DSS诱导急性结肠炎小鼠的治疗作用:A) 小鼠模型示意图。B) 治疗期间小鼠体重变化。C) 不同治疗组结肠组织对比照片。D) 不同治疗组结肠组织长度。E-G) 结肠组织中TNF-α(E)、IFN-γ(F)和IL-6(G)水平(n=5)。H) 不同治疗组结肠组织的H&E染色(黑色箭头:淋巴细胞浸润,红色箭头:隐窝损伤,标尺:200 μm)。I) 不同治疗组结肠组织的免疫组化染色。J) 各组结肠组织病理学评分。K) 不同治疗组髓过氧化物酶(MPO)阳性细胞定量分析。
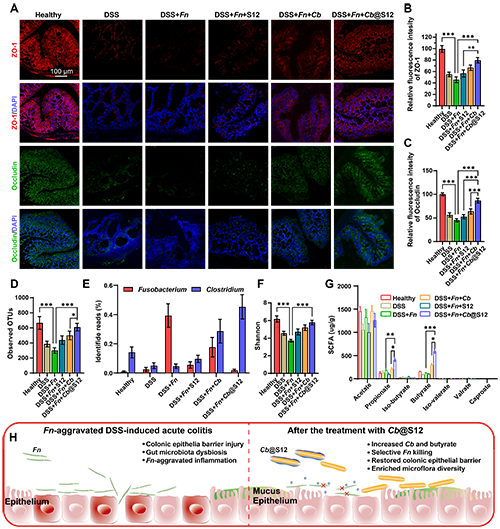
图5. Cb@S12缓解肠道炎症的治疗机制:A) 结肠组织中紧密连接蛋白ZO-1和Occludin的免疫荧光图像。Cb@S12治疗组中,ZO-1和Occludin的膜定位显著恢复,表明肠道屏障完整性修复。B, C) ZO-1 (B)和Occludin(C)的相对荧光强度定量分析(n=5)。D-F)16S rRNA测序分析肠道菌群:D)观察到的OTUs数量:Cb@S12组微生物多样性显著高于炎症模型组(P < 0.01);E) Fusobacterium和Clostridium的丰度F)肠道菌群Shannon多样性指数:Cb@S12组多样性恢复至健康水平(P < 0.001)。G)GC-MS分析粪便中短链脂肪酸(SCFA)含量。H)治疗机制示意图。
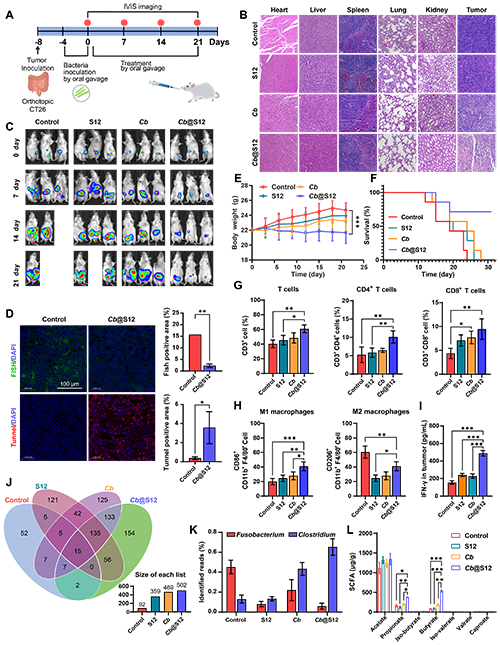
图6. Cb@S12对Fn相关的原位CT26肿瘤小鼠模型的抗癌作用评估。A) 小鼠CRC原位肿瘤模型实验流程图。B) 通过H&E染色评估各器官(心、肝、脾、肺、肾、肿瘤)的组织学变化,验证治疗的生物安全性和肿瘤组织的病理状态。C) IVIS监测肿瘤生长动态,显示Cb@S12组在肿瘤抑制方面的显著效果。D) 肿瘤组织中的Fn特异性荧光原位杂交(FISH)与凋亡TUNEL染色联合评估,确认其对致病菌抑制及诱导肿瘤细胞凋亡的效果。E) 记录治疗过程中的小鼠体重变化。F) 各组小鼠的生存曲线分析,Cb@S12组表现出明显的生存优势。G, H) 肿瘤内T细胞和巨噬细胞的流式分析I) 肿瘤组织中干扰素γ(IFN-γ)的水平升高,说明局部免疫应答被增强。J, K) 粪便中肠道菌群组成分析,比较了不同组中Fusobacterium和Clostridium的相对丰度及总OTUs数量,反映出对菌群的重塑效果。L) GC-MS分析粪便中短链脂肪酸(SCFA)含量。
本研究首次构建了一种基于益生菌的智能纳米平台(Cb@S12),通过“抗菌-消炎-免疫激活”三重机制,实现了Fn相关肠道疾病的高效治疗。该策略不仅避免了抗生素的广谱杀伤副作用,还通过益生菌的代谢功能重塑肠道菌群微生态,为IBD和CRC的联合治疗提供了潜在的治疗策略。研究证实,Cb@S12在动物模型中安全有效,具有潜在的临床转化价值。
以上研究成果以“Oral delivery of Clostridium butyricum using selective antibacterial lipids for enhanced treatment of Fusobacterium nucleatum-associated intestinal diseases” 为题,发表于Nano Today(2025, 62, 102742. DOI:10.1016/j.nantod.2025.102742)。天津工业大学高辉教授和天津医科大学肿瘤医院王舒瑜博士为通讯作者,天津工业大学博士研究生赵圣科和天津工业大学余云健讲师为共同第一作者。这项工作得到了科技部重点研发计划、国家自然科学基金、天津市自然科学基金重点项目的支持。
文章链接:https://doi.org/10.1016/j.nantod.2025.102742
- 东华大学朱美芳教授、贾超副研究员等 AFM:抗菌、制冷多功能聚乙烯纤维防护材料 2026-01-06
- 华东理工刘润辉教授课题组 Nat. Commun.:双胍化多肽模拟物抗多药耐药ESKAPE与脑膜炎 2025-12-12
- 浙大张庆华教授团队 AFM:定制化多功能Janus织物 - 实现透气、抗菌与舒适个人热湿管理 2025-11-19
- 天津科技大学钟成教授团队 Small:多功能不对称细菌纤维素伤口敷料 2023-08-23
- 青农大孔晓颖、康复大学师进生/周祺惠 AFM:激活的免疫系统通过抑制肿瘤相关成纤维细胞左右光疗的体内抗肿瘤效果 2024-02-20
- 河北工大邢成芬课题组《Nano Lett.》:基于近红外光响应共轭聚合物纳米粒子的免疫激活抗真菌策略 2022-12-27
- 复旦大学陈国颂-江明课题组在原位糖脱保护引发囊泡形貌转变和免疫激活研究中取得重要进展 2018-06-27
