青农大孔晓颖、康复大学师进生/周祺惠 AFM:激活的免疫系统通过抑制肿瘤相关成纤维细胞左右光疗的体内抗肿瘤效果
2024-02-20 来源:高分子科技
实体肿瘤微环境(TME)通常被大量免疫抑制的肿瘤相关成纤维细胞浸润,导致大多数肿瘤持续处于免疫“冷”状态。近十年来,光疗抗肿瘤研究证实,光热和光动力提供的热消融、活性氧/活性氮等自由基可促进肿瘤相关抗原的分泌,促进细胞氧化损伤,上调免疫原性细胞死亡和细胞热凋亡。因此,光疗与免疫治疗的有效结合有望实现抗肿瘤治疗效果的协同放大。然而,通过热消融以及光疗中活性分子激活的免疫系统是否直接参与肿瘤细胞的攻击还需要进一步的证据证实。为了揭示光疗过程中免疫系统的抗肿瘤作用,有必要从TME相关的角度探讨激活的免疫系统是否直接参与光疗的抗肿瘤治疗过程。

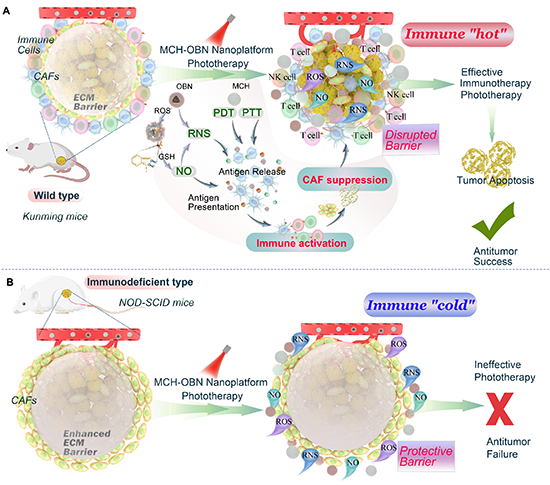
图1. 不同免疫状态下MCH-OBN光疗纳米平台抗肿瘤效果示意图。
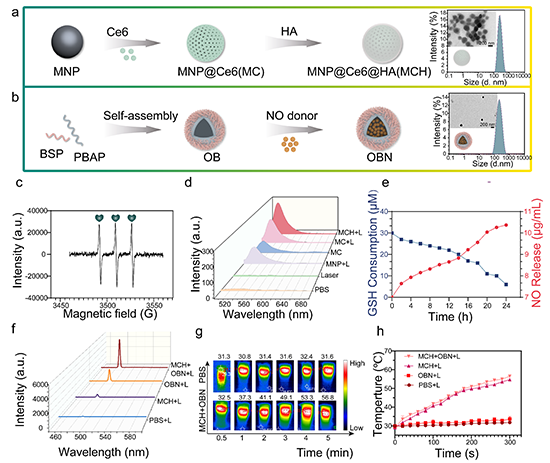
图2. MCH-OBN纳米平台的表征
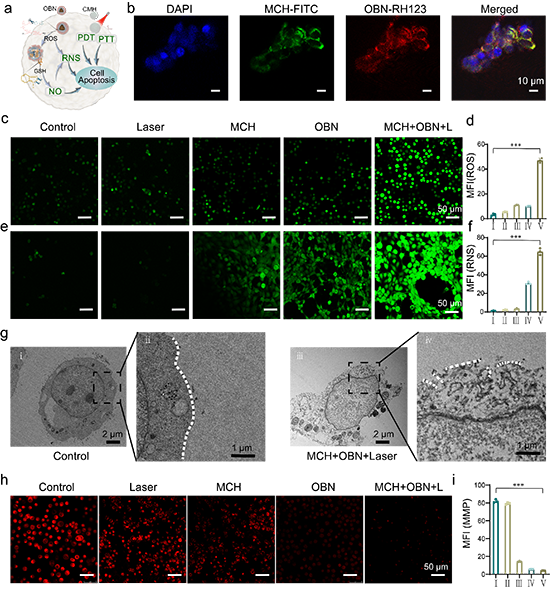
图3. 纳米颗粒的细胞摄取以及对细胞损伤
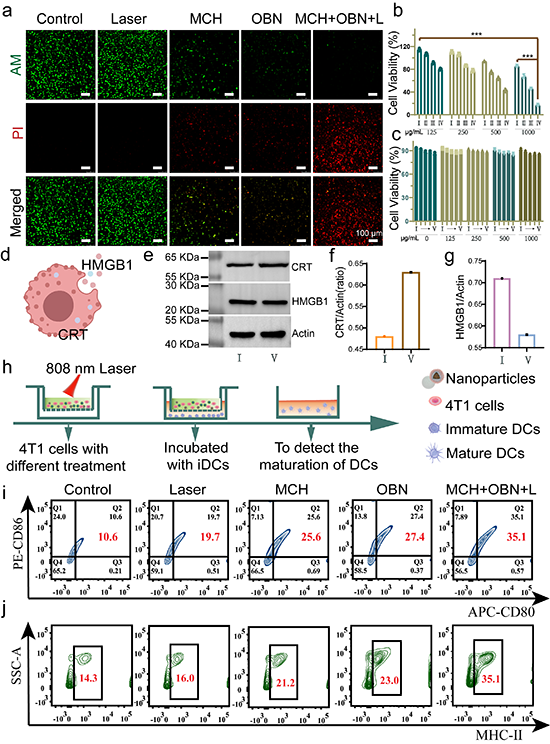
图4. MCH-OBN纳米平台体外抗肿瘤分析及DCs成熟
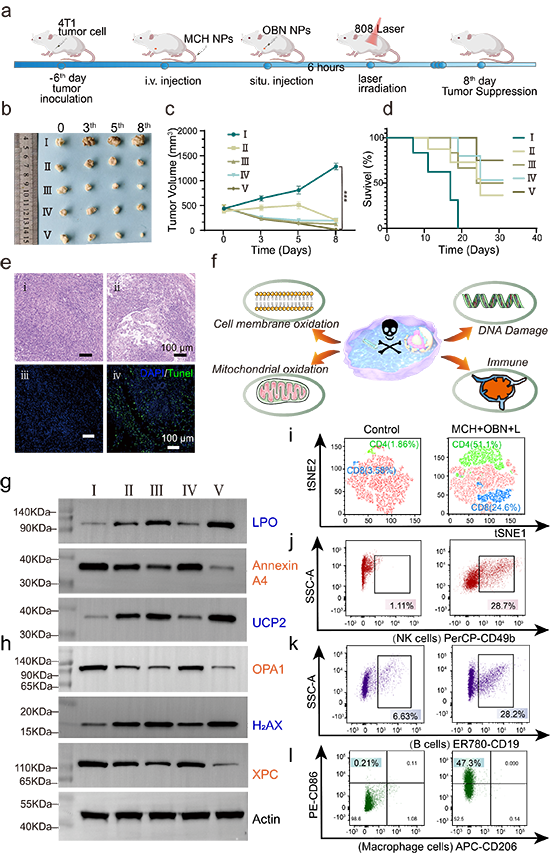
图5. 野生型小鼠体内抗肿瘤治疗及免疫分析

图6. NOD-SCID小鼠体内抗肿瘤治疗及免疫分析
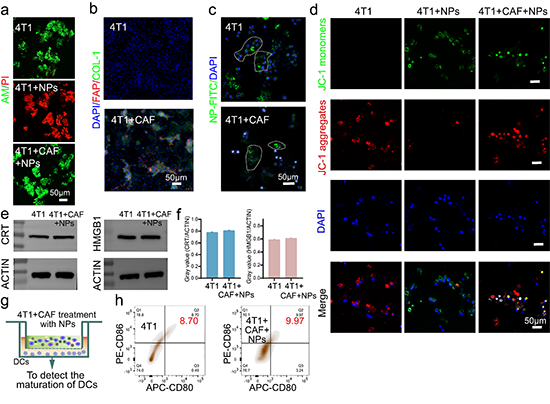
图7.调控光疗抗肿瘤机制的CAFs体外分析
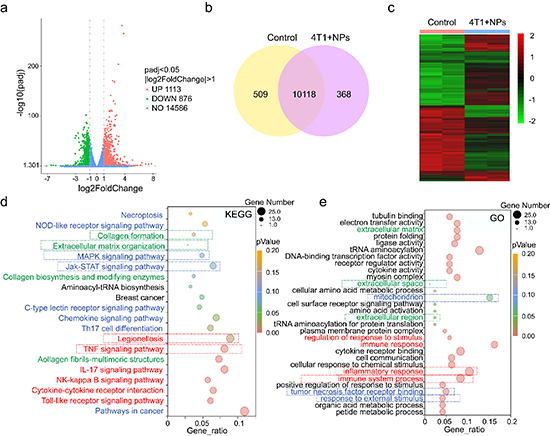
图8. MCH-OBN + Laser治疗后4T1肿瘤细胞转录分析

图9. MCH-OBN + Laser 治疗后CAF培养4T1肿瘤细胞的转录分析
总之,该工作首次关注了免疫状态对光疗抗肿瘤效果的决定性作用。MCH-OBN纳米平台对野生型和免疫缺陷小鼠的肿瘤疗效差异证实了光疗对免疫激活状态的强烈依赖性,在此基础上,研究者进一步证实了光疗中免疫系统通过破坏CAFs对肿瘤细胞的物理屏障促进肿瘤细胞死亡的生物调控机制,对临床开发以CAFs为靶点的免疫辅助光疗抗肿瘤策略具有重要意义。
原文链接:https://doi.org/10.1002/adfm.202315551
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 天工大高辉/余云健团队 Nano Today:选择性抗菌脂质递送丁酸梭菌增强具核梭杆菌相关肠道疾病治疗 2025-04-10
- 河北工大邢成芬课题组《Nano Lett.》:基于近红外光响应共轭聚合物纳米粒子的免疫激活抗真菌策略 2022-12-27
- 复旦大学陈国颂-江明课题组在原位糖脱保护引发囊泡形貌转变和免疫激活研究中取得重要进展 2018-06-27
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
- 天工大高辉/马飞贺/余云健 Small:疏水标签/低温光热协同增强肿瘤治疗 2025-07-11
