川大张兴栋院士团队王启光/樊渝江:自润滑杂化外泌体微凝胶通过体内靶向Foxo3基因编辑调控软骨细胞线粒体自噬以缓解骨关节炎进展
2025-01-24 来源:高分子科技
软骨细胞线粒体功能障碍是骨关节炎 (OA) 的核心致病因素,但直接调控体内线粒体稳态仍然面临诸多挑战。目前,众多研究已深入探讨了线粒体自噬对 OA 病程进展的影响,凸显出调节线粒体自噬水平对于保持 OA 软骨细胞正常运作及功能的重要性。近期研究更是进一步证实,激活软骨细胞内的 FoxO3 基因表达能够有效调控线粒体稳态,这对于维护 OA 软骨细胞的正常功能及抑制其受损和凋亡过程具有决定性作用。然而,鉴于软骨组织缺乏血管网络且细胞外基质高度密集,如何精准地靶向软骨细胞以实现体内 FoxO3 基因的激活,当前仍是一项亟待解决的难题。
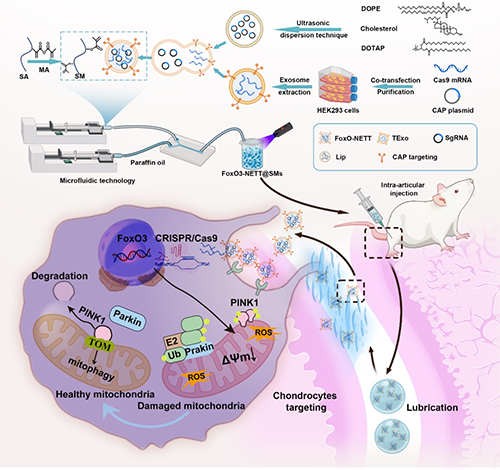
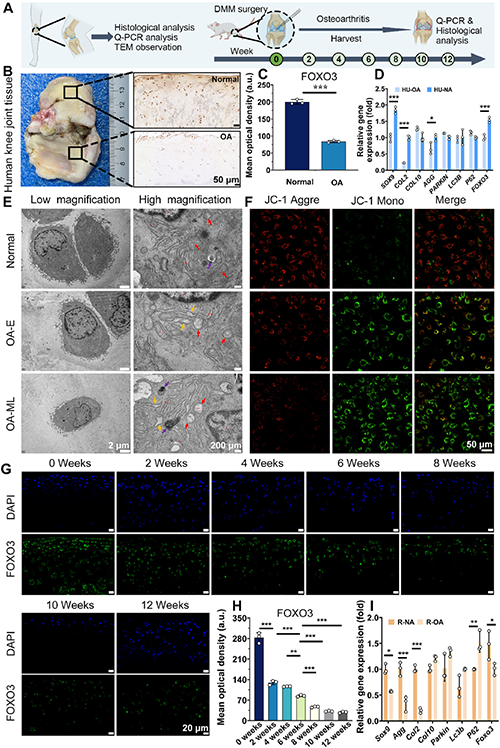
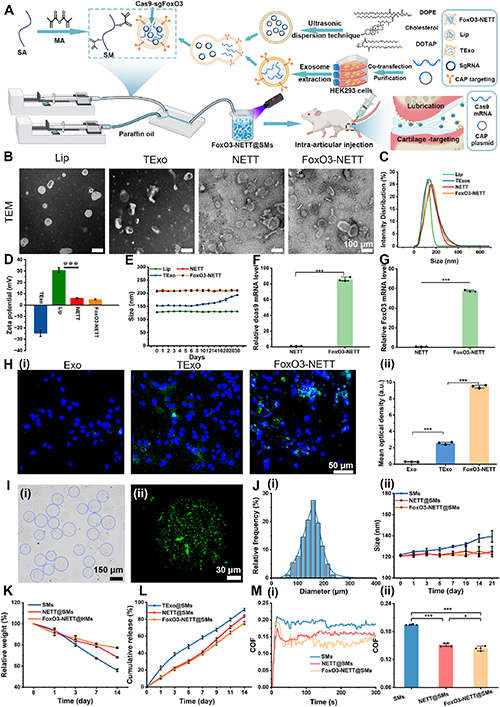
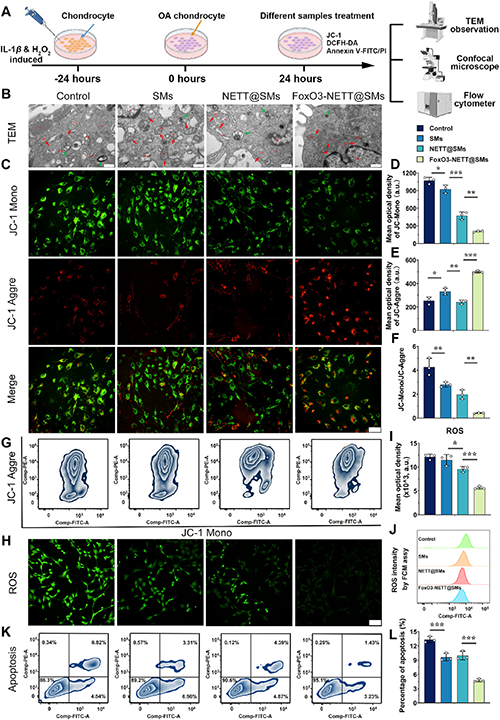
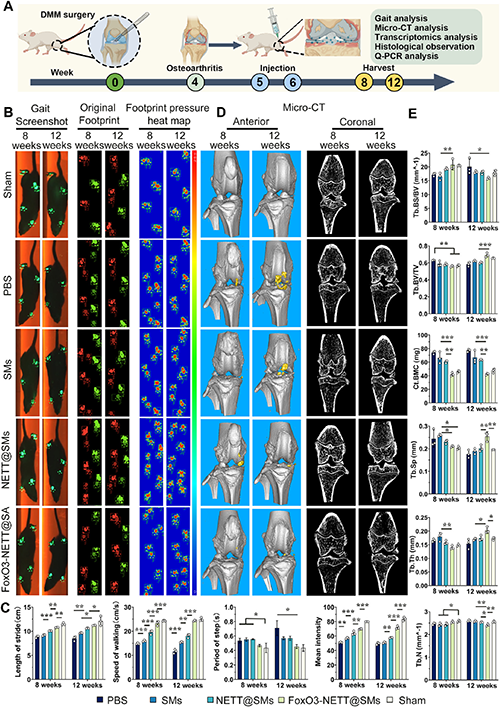
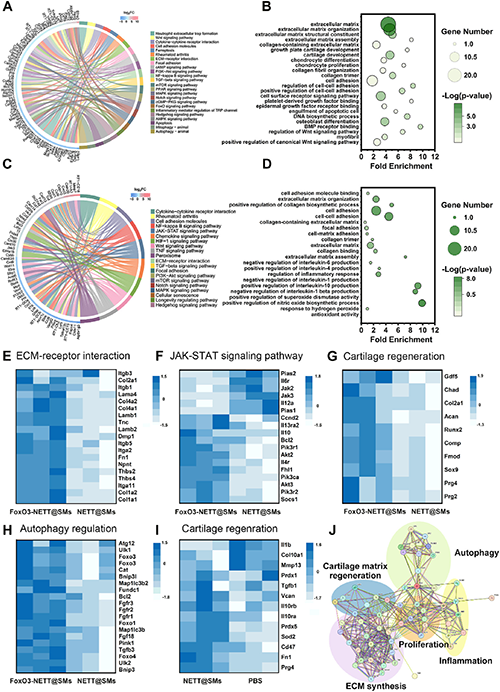
转录组分析和进一步的分子验证表明,FoxO3-NETT@SMs 通过调节 PINK1/Parkin 自噬信号通路来激活自噬,从而恢复线粒体动力平衡,促进软骨基质再生和分泌,并抑制炎症反应。
参考文献:
Nanoengineered cargo with targeted in vivo Foxo3 gene editing modulated mitophagy of chondrocytes to alleviate osteoarthritis
https://doi.org/10.1016/j.apsb.2024.12.008
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 西工大刘旭庆教授团队 AFM:新一代三维编织衬垫润滑材料 - 实现摩擦能量的协同管理与耗散 2026-02-01
- 西工大刘旭庆教授、兰州化物所张招柱研究员 AFM:三维氢键网络强化的芳纶基织物自润滑复合材料 2025-09-19
- 香港城大朱平安、柴愚《Newton》:热液滴的自润滑弹跳 2025-03-07
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 北京化工大学蔡晴/喻盈捷 AFM:三重生物粘附性微球赋能金属离子工程化外泌体疗法,实现血管化骨再生 2026-02-18
- 东南大学张天柱教授团队《ACS Nano》:封装脂肪干细胞外泌体补片用于调节炎症和促进组织再生 2025-06-09
- 浙江大学高长有教授团队 AFM: 新型棒状微凝胶支架促进皮肤愈合并减少瘢痕形成 2025-01-18
