四川大学李建树教授/杨佼佼副研究员 Small:用于清除胞内菌感染的级联靶向纳米系统
2024-05-08 来源:高分子科技
寄居在哺乳动物细胞内的细菌(胞内菌)会导致结核病、败血症和骨髓炎等危及生命的疾病,每年影响着全球数百万人。这些细菌在宿主细胞,尤其是巨噬细胞内繁殖,造成二次感染,导致细胞凋亡,并通过循环系统进一步扩散到全身。目前,临床上治疗这些感染的方法主要依赖于长期使用大剂量抗生素。然而,抗生素对宿主细胞缺乏特异性,难以有效穿透细胞膜,在细胞内的疗效通常较差。因此,治疗失败、复发和抗生素耐药性等问题普遍存在。清除胞内菌感染涉及靶向细胞和细菌两个层面的级联过程。在细胞层面,药物递送系统必须通过各种生理屏障,进入受感染的宿主细胞内部;到达在宿主细胞内之后,在细菌水平上,这些系统需要精确靶向细菌,并在细菌部位释放抗菌剂,从而提高抗菌效率,降低耐药性等风险。
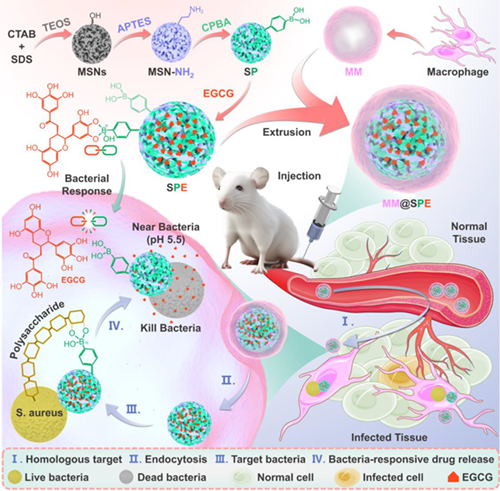
Figure 1. MM@SPE NPs 通过级联靶向和细菌微环境响应机制清除胞内菌的示意图。
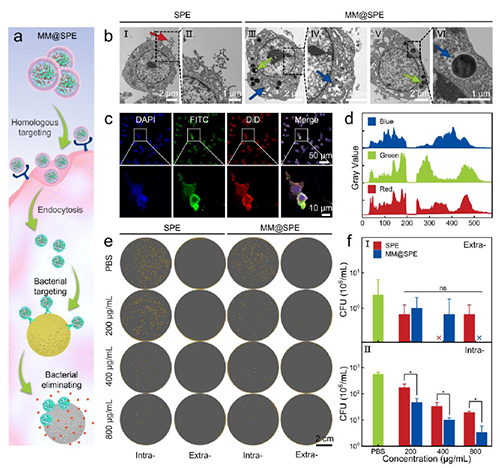
Figure 2. MM@SPE NPs 的级联靶向和细菌响应抗菌性能。
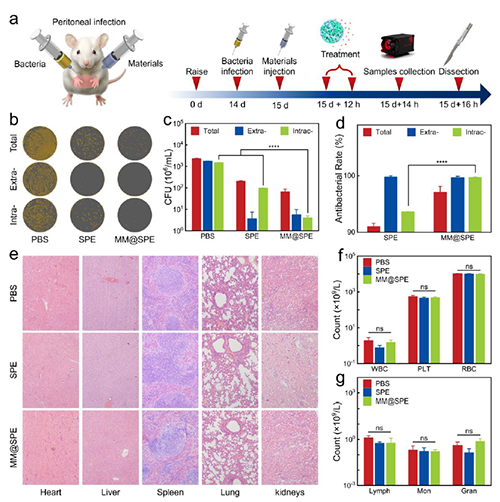
Figure 3. MM@SPE NPs 在金黄色葡萄球菌感染小鼠体内的抗菌效果。
文章链接:https://onlinelibrary.wiley.com/doi/full/10.1002/smll.202311967
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 武汉科技大学王晓强《Nano Lett.》:基于硼簇的“离液效应”构建细菌响应型水凝胶用于近红外二区光热治疗 2024-04-09
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
- 东南大学葛丽芹教授与合作者 Research:微气泡为模板的免疫活性金属多酚胶囊用于药物递送和增强的肿瘤免疫治疗 2025-07-31
- 四川大学丁明明教授团队 Angew: 可视化β折叠到β转角构象转变的荧光聚合物囊泡及其用于颜色报告型药物递送 2025-07-11
- 吉林大学钱虎军教授团队 PRL:单链纳米粒子突破高分子材料“强度-韧性-加工性”三难困境 2025-10-15
- 华工殷盼超/广工尹家福团队 Nano Lett.:软纳米粒子多时空动力学解析 2025-08-21
- 北京化工大学王兴/李国锋团队《ACS AMI》:通过聚氨基酸纳米粒子现场递送抗生素消灭细胞内持留性金黄色葡萄球菌 2025-08-16
