近年来,抗癌药物输送系统已成为克服传统化疗局限性的一种有前景的方法,包括改善体内药物的生物分布和减少全身副作用。不幸的是,目前的递送系统仍面临靶向不足和肿瘤内药物释放有限等挑战。此外,由于细胞内溶酶体的酸性环境和内体中大量的酶,这些递送系统在被肿瘤细胞内化和随后的溶酶体隔离后易被降解和破坏,导致药物失活,影响治疗效果。因此,药物递送过程中药物分子及时的内体逃逸仍然是一个主要的瓶颈。微波热疗因其对生物组织的穿透深度深、加热效率高、副作用小,且易于与其他疗法联合使用成为近年来最有前途的技术之一。同时,与光刺激相比,微波也是触发产生活性氧用于肿瘤治疗的优质能源。这些独特的特征使得基于微波的疗法在治疗深部组织肿瘤方面比光热疗法更有吸引力。因此,微波热疗联合化疗是一种更有效的策略,相比单一疗法兼具热疗和药物化疗的双重优势,同时具有远程控制和按需释放药物的能力,增强癌症治疗效果。


图1. 基于可变形磁性液态金属纳米平台通过微波驱动的形状转换进行细胞内药物输送和磁共振成像引导的微波热化疗的示意图
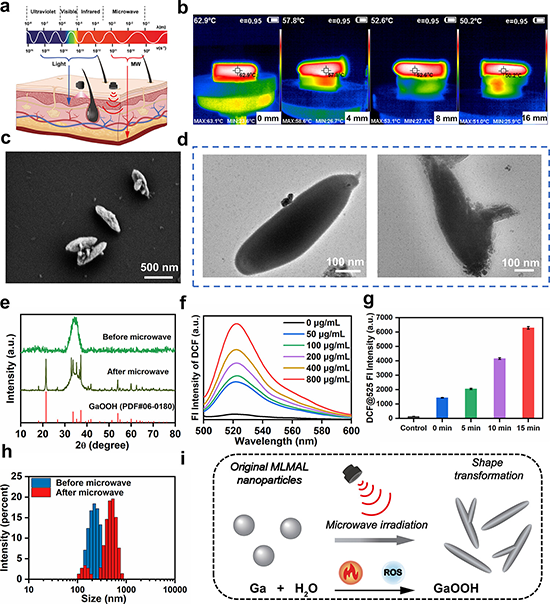
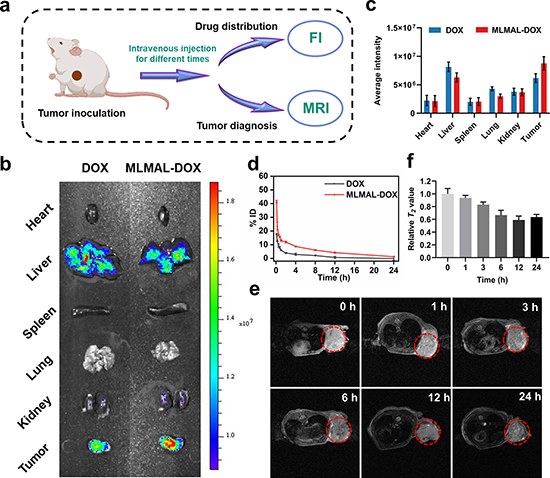

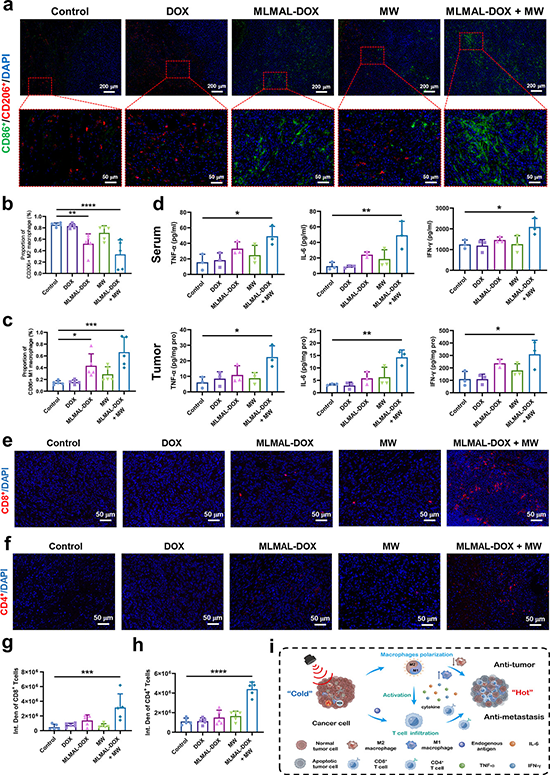
图5. 体内激活免疫效应重塑肿瘤微环境
研究发现该纳米平台可以吸收和转换微波能量以增强热效应并驱动从纳米球到大棒的形状转变,这种由微波驱动的剧烈形状变化和体积增加能够导致细胞内体膜的物理破坏,诱导药物分子逃逸内体,从而实现受控药物释放。鉴于微波能量的深部组织穿透特性,这项研究为深部组织和肿瘤治疗中的精确药物输送提供了可能性。全身给药后,载药MLM纳米平台改善阿霉素药物在体内的血液循环时间和肿瘤位置的积累。同时,该纳米平台表现出灵敏的磁共振成像(MRI)功能,可用于成像引导治疗。此外,该纳米平台可以通过微波热化疗的协同增效将肿瘤相关巨噬细胞(TAM)从促肿瘤M2表型重新编程为抗肿瘤M1表型,激活免疫调节作用,将“冷”肿瘤变成“热”肿瘤,免疫抑制性肿瘤微环境(TME)被逆转,进一步启动T细胞介导的免疫反应,从而抑制肿瘤生长和肺转移。因此,这种精心设计的微波触发的可变形磁性液态金属纳米平台有望用于精确靶向药物输送和高效癌症治疗。
原文链接: Zonghao Liu, Weikun Li, Xin Tan, Yueru Huang, Yinghua Tao, Ning Yang, Renqiang Yuan, Ling Liu, Liqin Ge. Transformable Magnetic Liquid-Metal Nanoplatform for Intracellular Drug Delivery and MR Imaging-Guided Microwave Thermochemotherapy. ACS Appl. Mater. Interfaces. 2024.
DOI: 10.1021/acsami.3c17891
https://pubs.acs.org/doi/full/10.1021/acsami.3c17891
- 吉林大学孙俊奇教授课题组 NSR:基于强韧且可变形的纳米相区制备超高强度和超高韧性的可逆交联塑料 2025-11-22
- 北化田明教授、宁南英教授课题组《Adv. Mater.》:通过填充拉伸可变形的软质填料制备高发电性能的介电弹性体 2023-05-25
- 港中大张立教授/赵伟仁教授/陈启枫教授、浙大潘程枫研究员《Sci. Adv.》:无线供能的柔性电子支架用于食道贲门无创电刺激 2023-03-11
- 昆士兰大学乔瑞瑞教授团队 AFM:液态金属纳米颗粒赋能高分辨水凝胶3D打印 2025-12-01
- 厦门大学白华课题组 Matter:液态金属有机高内相乳液用于同轴3D打印弹性导电纤维 2025-11-07
- 四川大学李忠明/鄢定祥/贾利川 Nat. Commun.:基于有限凝胶网络设计的高浓度液态金属油墨 2025-10-21
- 浙江大学王立教授、俞豪杰教授团队 JCIS:用于安全磁共振成像和刺激响应药物递送的纳米粒子 2025-09-09
