阿尔茨海默病(Alzheimer’s Disease, AD)作为最常见的神经退行性疾病,目前仍然是世界前十大疾病中唯一一个无法预防、治愈和延缓的疾病。AD作为脑部疾病其复杂的致病机制和难以逾越的血脑屏障成为其治疗中最重要的2个难点。为克服血脑屏障,改善AD的病理特征,四川大学高会乐教授课题组前期构建了一系列的脑靶向纳米粒用于AD的联合治疗,显著提高了AD模型小鼠的记忆水平(Adv Funct Mater 2020,Acta Pharm Sin B 2021, Adv Sci 2022, Research 2023,Adv Mater 2023)。然而这类纳米递送系统均为静脉注射,这对于长病程的AD而言无疑会增加感染风险和降低患者依从性。基于此,四川大学高会乐课题组创新性的提出了口服脑靶向纳米制剂用于AD的联合治疗,该研究近期发表在ACS Nano上。
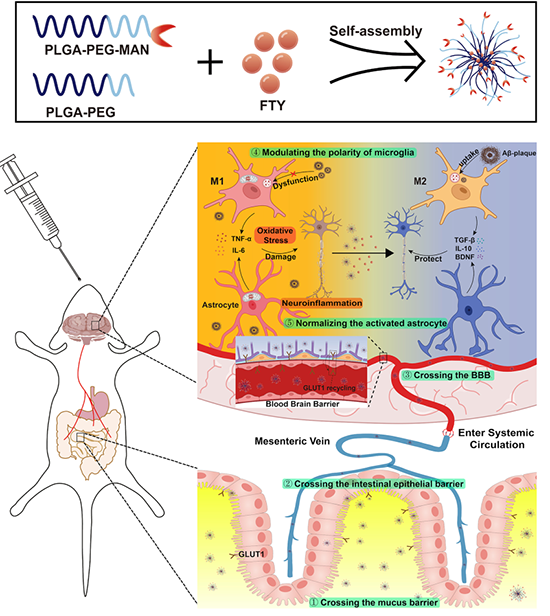
团队基于体内天然生理屏障的吸收特性,开发了一种能够克服口服入脑多重复杂屏障的纳米颗粒用于AD的多靶点治疗。选用PLGA-PEG为纳米载体骨架,利用其亲水性和带负电的特性促进纳米粒在粘液屏障的快速渗透,同时也避免了单核吞噬系统对纳米粒的清除从而增加纳米粒在体内的循环时间。随后通过在PEG末端接枝适量α-吡喃甘露糖苷实现对肠上皮细胞和脑内皮细胞上GLUT1的双重靶向。此外,为了进一步提高甘露糖修饰纳米粒的入脑效果,该团队采用了血糖调控策略使得纳米粒能够搭乘GLUT1从血管侧至脑实质侧的循环表达的便车而进入脑部。最后纳米粒包裹的芬戈莫德从中释放,调控了异常活化的小胶质细胞和星形胶质细胞:(1)将小胶质细胞从促炎M1表型转化为抗炎M2表型,恢复了其对Aβ和Tau等有毒蛋白质的吞噬能力,降低了炎症介质的释放。(2)正常化激活的星形胶质细胞不仅减少了促炎因子的释放,还增加了抗炎因子和神经保护因子的释放。最终缓解了神经炎症和氧化应激,有效地重塑AD异常病变微环境。该研究考虑了纳米药物临床转化至关重要的多重因素,包括首选给药途径、稳定性和安全性等,开发了一种简单高效的纳米递送系统。纳米粒子通过适应生理屏障的变化,从而克服口服入脑的多重障碍,实现了AD的多靶点治疗,为AD药物的创新发展提供了新的思路。
原文链接:https://doi.org/10.1021/acsnano.3c09715
- 东华大学史向阳教授团队 Nano Today:基于含磷树状大分子的药物递送系统协同增强自噬、抗炎和抗氧化治疗阿尔茨海默症 2025-02-11
- 华中大罗亮教授团队《Adv. Mater.》:基于刚性共轭聚合物的多价纳米抗体偶联物用于阿尔茨海默症多靶点治疗 2023-02-24
- 港中深唐本忠院士/河大师冰洋教授/王杰菲副教授 Angew:新型近红外AIE用于阿尔茨海默症的体内诊疗一体化 2022-11-12
- 昆士兰大学乔瑞瑞教授团队 AFM:液态金属纳米颗粒赋能高分辨水凝胶3D打印 2025-12-01
- 北化许海军教授团队 CEJ: 低成本原位光催化技术突破摩擦纳米发电机高性能电极瓶颈 →在疏水性聚合物表面原位生长银纳米颗粒电极 2025-08-07
- 华南理工大学王林格教授团队 Small:以聚合诱导自组装方法制备与调控具有刚性直链成核链段的球状液晶纳米颗粒 2025-07-13
- 复旦大学俞麟教授和上海第十人民医院彭琛副研究员合作开发三模式生物成像技术用于揭示PLGA-PEG-PLGA热致水凝胶体内降解机理 2020-07-07
