感染会阻碍伤口愈合过程,甚至可能导致危及生命的并发症,如组织坏死、器官衰竭和败血症。因此,早期及时发现和治疗感染性病原体对于防止伤口进一步恶化至关重要,并有利于伤口护理。目前,临床检测病原体的金标准主要包括平板培养、聚合酶链反应(PCR)、测序等。虽然这些方法相对灵敏可靠,但复杂的工作流程,包括繁琐的样品预处理和数小时至数天的检测时间,可能会错过治疗机会。此外,这些检测方法的应用受到对精密仪器和熟练操作人员需求的限制,使其难以在医疗资源有限的地区或在现场实施。因此,迫切需要开发简单、快速、经济、可现场操作的伤口感染性病原体检测分析策略。当前,无需实验室设施的即时检测(POCT)方法已经成为一种可行的替代方法,也是病原体检测研究的焦点。虽然POCT方法在检测伤口细菌方面卓有成效,但它们通常没有考虑到伤口护理的其他重要方面,如伤口保护、抗菌特性和促进愈合。此外,以往主要基于伤口温度、pH变化判定伤口感染程度的方式,其准确性往往受环境和生理干扰因素较大。
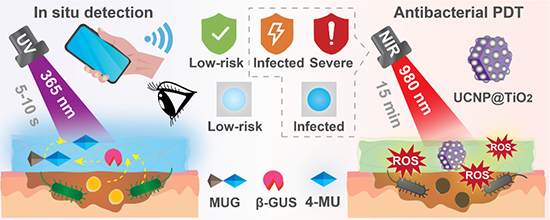
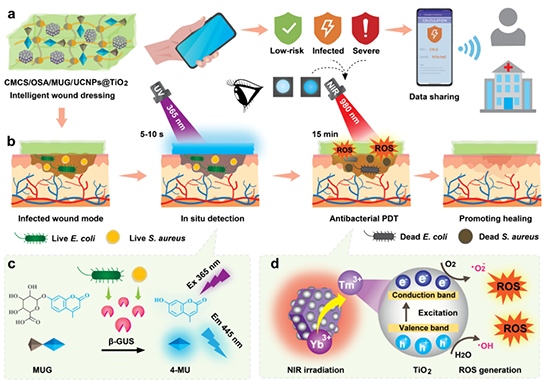
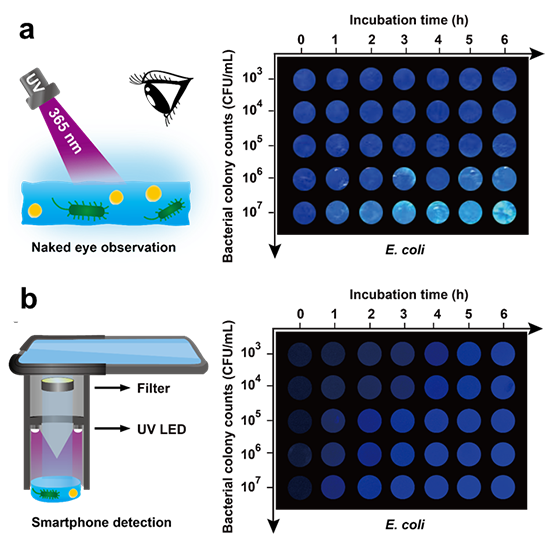
已知MUG分子含有糖苷键,可被β-GUS酶解成4-MU和β-D-葡萄糖醛酸,而4-MU在紫外光照射下可产生蓝色荧光。由于常见的伤口病原菌,如大多数肠杆菌科、金黄色葡萄球菌、肺炎链球菌和铜绿假单胞菌都能分泌β-GUS,因此将MUG掺入透明度较高的水凝胶敷料中可以实现伤口细菌的原位可视化检测。该研究分别通过肉眼和智能手机检测装置观察水凝胶敷料—大肠杆菌共孵育后蓝色荧光强度变化。结果表明,在相同的培养时间下,荧光强度随细菌浓度的增加而增加,表明可以实现细菌的可视化检测与感染程度判定。但与基于智能手机的检测装置相比,裸眼识别的灵敏度较低。只有当细菌浓度高于106 CFU/mL时,可以裸眼观察到显著荧光强度差异;而在智能手机检测装置中,细菌浓度为103 CFU/mL即可观测到显著荧光变化。同时,ImageJ处理结果显示出了类似的变化趋势。在此,裸眼的低灵敏度主要是由于紫外线光源的位置和角度变化、水凝胶的表面光反射、环境光的干扰等导致激发光强度不一致,这也是裸眼检测的共性问题。据报道,当伤口细菌数量达到105左右时,通常可被认定为感染。因此,虽然可以通过裸眼观察识别已感染的伤口,但为了实现感染的早期发现,还是需要借助智能手机检测装置。

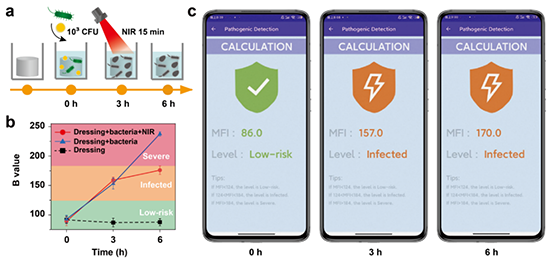
该研究采用全层皮肤缺损SD大鼠,评价了智能伤口敷料的体内细菌检测及抑制作用。与正常伤口相比,在紫外线照射下,感染伤口可见蓝色荧光。感染创面第0天通过智能手机检测系统测得B值约为221,明显高于正常组(约120),表明创面处于“Severe”感染阶段。感染创面B值随着近红外光处理逐渐降低,直至与正常组一致,说明创面细菌数量减少,并得到有效抑制。提取不同时间点创面渗出液进行细菌培养。近红外光处理后的细菌数量明显减少。第6天几乎没有观察到明显的菌落。大肠杆菌和金黄色葡萄球菌的存活率均降至5%以下。值得一提的是,该研究中的抗菌治疗仅在敷料更换时进行。因此可以推断,增加抗菌治疗次数将加速细菌清除效果。以上结果表明,该智能伤口敷料具有良好的细菌检测和响应性抗菌能力,可作为一种新型伤口敷料用于伤口感染的原位检测和按需抗菌治疗。

兼具原位检测和清除细菌的智能伤口敷料可以准确评估创面细菌感染情况,根据需要进行精准抗菌治疗,从而提高创面护理效率,促进创面个性化治疗。然而,目前这类敷料报道较少。虽然可以通过在敷料中嵌入复杂的生物传感器或电子元件来实现原位细菌检测,但是较高的生产成本和复杂的伤口护理方式具有应用局限。同时,以往主要基于伤口温度、pH变化判定伤口感染程度的方式,其准确性往往受环境和人体生理干扰因素较大。此外,尽管使用颜色变化作为伤口感染检测是一种方便实用的方法,但是仅仅依靠裸眼识别和判断的视觉检测方法往往受到个体感官差异的影响。由于当前智能手机的广泛使用和固有优势,包括高效率、非侵入性、便携性以及安装第三方APP作为信号读取器的能力,因此基于智能手机的POCT方法受到了较高关注。此外,伤口愈合的实时过程数据可以根据需要传送给远程医疗人员,从而实现远程护理。
原文链接:https://doi.org/10.1016/j.actbio.2023.11.045
- 哈佛大学医学院陶伟教授Cell子刊综述:针对性传播感染类疾病即时检测的纳米材料平台 2021-07-30
- 温州医科大学附属第二医院陈一杰团队 AHM封面:细菌毒素响应型仿生纳米气泡用于精准光动力抗菌治疗 2022-09-30
- 北化徐福建教授/俞丙然教授团队、北京协和医院睢瑞芳教授 AFM:靶向性光动力抗菌纳米组装材料用于多药耐药生物膜感染的角膜炎治疗 2021-12-22
- 四川大学王云兵教授团队:协同化学和光动力抗菌治疗的多功能光敏性纳米颗粒增强伤口愈合 2019-11-24
- 福州大学黄达/南科大吴德成 AHM:集成pH探针和超声响应性微囊的可注射水凝胶用于伤口可视化监测和按需治疗 2024-01-16
- 中科院化学所张军/田卫国、国家纳米中心孙斐婓 AFM:纤维素基Janus智能敷料 - 用于糖尿病伤口渗出液管理与可视化监测 2023-10-15
- 哈工大任玉坤教授团队《Adv. Mater.》:用于渗出液管理和慢性伤口按需治疗的无线闭环智能敷料 2023-09-05
