川大高会乐/曹俊 Adv. Sci.综述:PD-L1在癌症治疗中的空间异质性表达行为 - 挑战与机遇并存
2023-11-12 来源:高分子科技
2023年11月07日,四川大学华西药学院高会乐教授与四川大学生物医学工程学院曹俊研究员团队在Advance Science期刊合作发表了针对明星蛋白PD-L1最新调控机制名为“Challenges Coexist with Opportunities: Spatial-Heterogeneity Expression of PD-L1 in Cancer Therapy” 的综述论文。

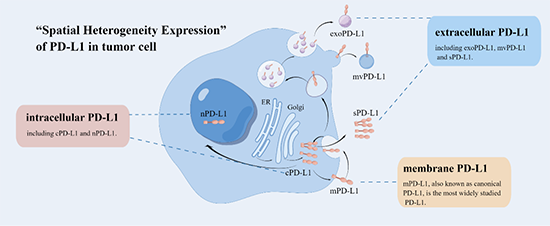
图1 PD-L1“空间异质性表达”的示意图。PD-L1在内质网(ER)中合成,并经高尔基体修饰后,既可以传输至细胞膜(mPD-L1),也可以继续存在于细胞质(cPD-L1)和细胞核(nPD-L1),还可以分泌至细胞外(sPD-L1)。除此之外,mPD-L1既能通过直接出芽形成微囊泡(mvPD-L1),也能被内吞至细胞质并分泌至细胞外环境形成外泌体(exoPD-L1)。各个部位的PD-L1含量处于高度动态变化中。

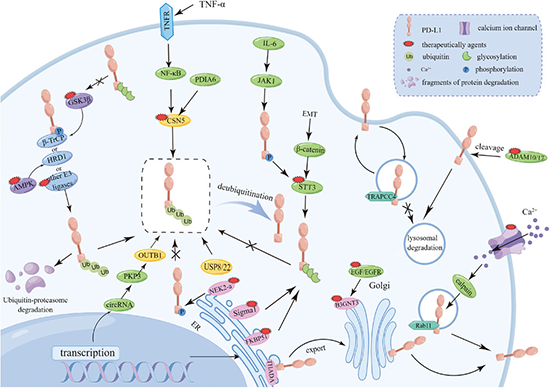
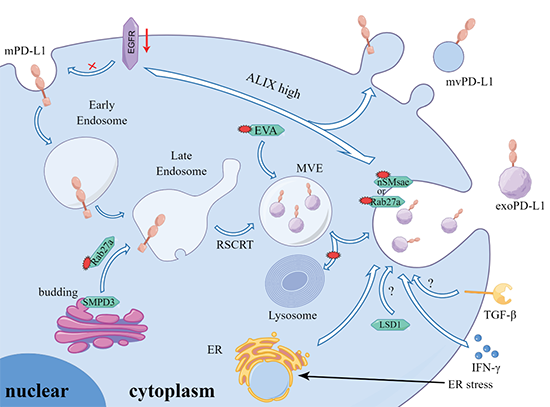
图 4 描述了 exoPD-L1 的调控机制和治疗策略。调控exoPD-L1表达的策略既可以由mPDL1衍生,也可以由高尔基体中新合成的cPD-L1衍生。此外,一些细胞因子如转化生长因子TGF-β和IFN-γ也可以促进exoPD-L1的产生。绿色多边形表示参与调节exoPD-L1的酶,红色小多边形表示靶向相应靶点的小分子调节剂。
论文信息:https://doi.org/10.1002/advs.202303175
版权与免责声明:中国聚合物网原创文章。刊物或媒体如需转载,请联系邮箱:info@polymer.cn,并请注明出处。
(责任编辑:xu)
相关新闻
- 东华大学郭睿教授/史向阳教授课题组 Acta Biomater.:仿生纳米平台介导的缺氧-腺苷轴破坏和PD-L1敲除用于增强MRI引导的化学动力学/免疫治疗 2025-06-27
- 深大附属华南医院马婧、法国CNRS彭玲团队 AM: PD-L1抗体偶联PAMAM树形分子纳米体系抑制癌症糖酵解和促进免疫应答 2023-12-17
- 东华大学郭睿教授/史向阳教授课题组《ACS AMI》:双响应核壳树状分子用于肿瘤细胞的基因编辑增强免疫检查点阻断治疗 2023-03-24
- 扬州大学吴德峰教授团队 ACS AMI:双层多糖水凝胶的异质性调控以实现多模式的驱动与传感 2023-03-19
- 湖南师大刘固寰教授团队 Angew:抗体-聚催化剂偶联物构建细胞环境下适用的ELISA 2024-11-03
- 复旦大学占昌友教授团队:羟基PEG可规避人群预存抗PEG抗体 - 助力LNP高效递送 2024-10-30
- 东华大学沈明武/史向阳ACS Nano:脑内递送仿生含磷树状大分子/抗体纳米复合物用于调节T细胞和自然杀伤细胞增强胶质瘤免疫治疗 2024-03-28
