胶质瘤是中枢神经系统中最具侵袭性和致死性的肿瘤之一,患者的中位生存期短,预后差,因此仍然是临床医学中最具挑战性的疾病之一。传统的治疗方法包括手术、化疗和放疗,然而由于血脑屏障(BBB)和胶质瘤细胞的浸润,传统治疗往往难以改善患者的功能预后和治疗效果。相比之下,免疫疗法具有毒性轻、不良反应少、疗效高的特点,在各种疾病的治疗中展现出巨大的潜力。
基于免疫检查点阻断(ICB)的免疫治疗利用相关抑制剂(如程序性细胞死亡蛋白1(PD-1)抗体(aPD1)和程序性细胞死亡配体1(PD-L1)抗体)阻断负性免疫调节途径,重新激活抗肿瘤免疫应答。特别是,PD-1是一种在T细胞和自然杀伤细胞(NK)上均表达的抑制性受体,可与多种肿瘤细胞上表达的PD-L1结合,从而导致肿瘤的免疫逃逸。此外,NK细胞作为淋巴细胞中的一种先天免疫细胞,具有直接破坏肿瘤细胞的能力,同时也可以协助T细胞破坏异常细胞。阻断T细胞和NK细胞上的PD-1受体,重新激活免疫细胞,对于使用aPD1等抑制剂改善肿瘤免疫治疗具有至关重要的意义。
对于神经胶质瘤的免疫治疗,由于大多数治疗药物分子(如抗体和酶)必须穿过血脑屏障才能到达肿瘤部位,这一过程被证明是困难的。因此,开发一种能够穿透血脑屏障的多功能药物传递系统,有效地将抗体递送到脑胶质瘤部位显得尤为重要。近年来,研究人员对纳米技术进行了大量的研究,发现仿生纳米技术在药物递送领域有着巨大的潜力。其中,利用细胞膜构建的仿生纳米药物以其优异的生物相容性、长循环效应和脑靶向性可以高效地促进纳米材料穿透血脑屏障。
除了抗体介导的ICB治疗外,开发具有内在免疫调节活性的纳米载体系统用于联合和增强肿瘤免疫治疗也至关重要。在许多不同的递送体系中,含磷树状大分子以其高度支化的三维结构、可功能化的表面和均匀的分子量而备受关注。亚磷酸钠盐封端的含磷树状大分子不仅可以作为纳米载体递送化疗药物,还可以作为免疫调节剂调节NK细胞、巨噬细胞等用于对抗炎症性疾病或肿瘤。此外,亚磷酸钠盐封端的含磷树状大分子已被证明是一种通用的蛋白质递送系统,因为它们具有末端亚磷酸钠盐阴离子基团和富含苯环的支链支架结构,并且可以通过静电相互作用、氢键、阳离子-Π和疏水相互作用负载蛋白质。

图1. AK128-aPD1@M1m纳米药物的制备及协同调节NK细胞和T细胞增强胶质瘤的免疫治疗。

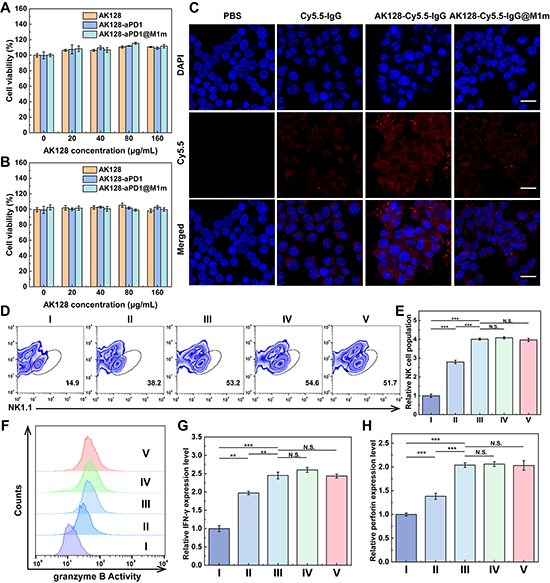
图3.(A-B)不同材料处理24 h后的C6细胞和bend.3细胞的活力测定。(C) 激光共聚焦显微镜观察巨噬细胞对不同材料的摄取情况。(D-E)不同材料处理PBMCs后NK细胞比例的代表性流式细胞术图和定量分析图。不同材料处理后(F)颗粒酶B的荧光强度直方图,(G)IFN-γ和(H)穿孔素的表达分泌测定。(D-H):Ⅰ,PBS;Ⅱ- 2;Ⅲ,Il-2 + AK128;Ⅳ,IL-2 + AK128-aPD1;V,IL-2 + AK128-aPD1@M1m。

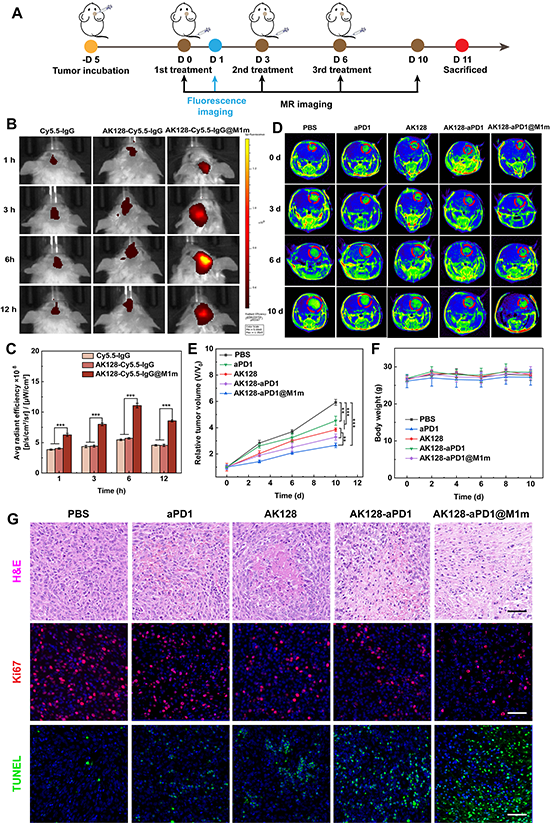
图5.(A)原位胶质瘤的体内诊断和治疗过程。(B-C)小动物活体荧光成像系统测定不同材料处理后荷瘤小鼠脑部的活体荧光成像图片和平均辐射效率。(D)不同处理后C6胶质瘤小鼠的MR图像、(E)相对肿瘤体积变化和(F)小鼠体重变化。(G)不同材料组小鼠脑胶质瘤切片的H&E、TUNEL、Ki67染色。
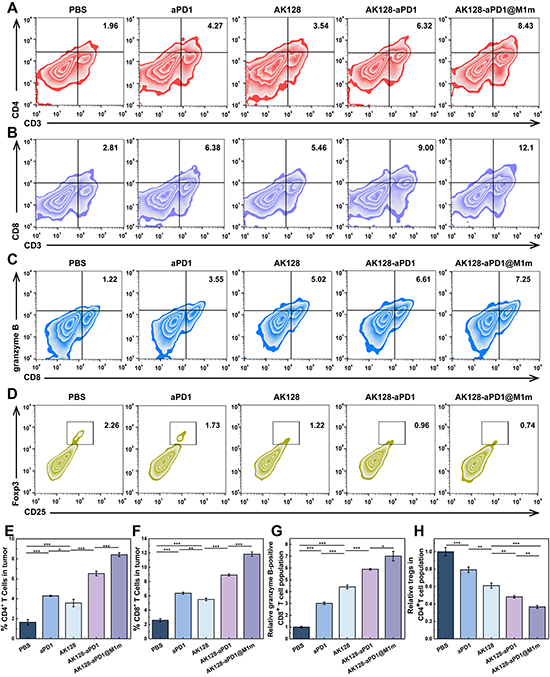
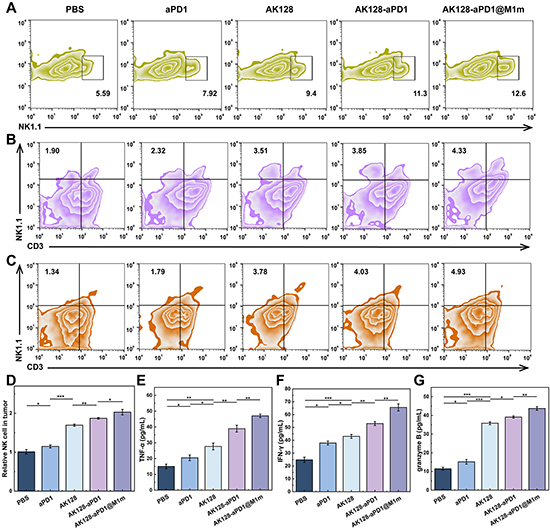
图7.(A-C)不同材料治疗11天后外周血、肿瘤和脾脏部位CD3-NK1.1+细胞的代表性流式细胞术图。(D)不同治疗材料后肿瘤组织中NK细胞分布的定量分析。(E-G)不同材料治疗11天后血清细胞因子TNF-α、IFN-γ、颗粒酶B的ELISA测定结果。
接下来,团队探索了AK128-aPD1@M1m NCs抗肿瘤的相关免疫治疗机制,采集治疗后11天小鼠的脑部,对相关免疫细胞进行了流式细胞术分析,结果表明AK128-aPD1@M1m组在肿瘤中的CD4+T细胞、CD8+ T和颗粒酶B阳性CD8+ T细胞比例均最高(图6A-C、6E-G),调节性T细胞(Tregs)的分布在所有组中最低(图6D、6H)。此外,团队研究了NK细胞在外周血、肿瘤和脾脏中的分布,AK128-aPD1@M1m治疗在所有组中NK细胞的外周血、肿瘤和脾脏分布均最高(p < 0.05,图7A-D)。综上所述,AK128-aPD1@M1m可以通过T细胞和NK细胞的协同调节,充分激活免疫反应,诱导有效的免疫治疗。同时通过ELISA法检测小鼠血清中TNF-α、IFN-γ、颗粒酶B水平(图7E-G)发现,AK128-aPD1@M1m组在所有组中显示出三个指标的最高水平(p < 0.01)。
简而言之,该研究设计的仿生纳米材料具有多个优势:1)亚磷酸钠盐封端的AK128与aPD1络合并用M1m伪装,形成了一种成分简单、能够延长血液循环时间且能跨越血脑屏障的纳米药物;2)具有免疫调节活性的AK128可以促进PBMCs中NK细胞的增殖,而递送的aPD1可以通过ICB重新激活T细胞和NK细胞,促进肿瘤细胞凋亡,从而提高胶质瘤的免疫治疗效果,实现对免疫细胞的多重调节,为脑胶质瘤的免疫治疗提供了一种新策略。
文章链接:https://doi.org/10.1021/acsnano.3c13088
- 东华大学史向阳教授团队 BAM:具有自身生物活性的羟基化含磷树状大分子脑内递送纤连蛋白协同调节小胶质细胞实现帕金森病的增强治疗 2024-04-26
- 东华大学沈明武研究员/史向阳教授团队 AFM:仿生外泌体伪装的pH响应型树状大分子纳米凝胶作为疫苗通过重编程多种细胞类型治疗胰腺癌 2026-02-20
- 南京大学王炜/曹毅/薛斌团队 Nat. Commun.:仿生分级picot纤维水凝胶涂层实现超低摩擦与高耐磨性 2026-02-09
- 武汉大学刘兴海教授团队《Small》:仿生超韧快速响应水凝胶 2026-02-02
- 东华大学沈明武研究员/史向阳教授团队:不对称含磷树状大分子递送菠萝蛋白酶用于骨关节炎的抗炎和软骨保护治疗 2025-06-13
- 东华大学沈明武/史向阳团队《Acta Biomater.》:含磷树状大分子介导的生物矿化用于协同的肿瘤阻断治疗与乏氧激活化疗 2025-04-28
- 东华大学史向阳教授团队 Nano Today:基于含磷树状大分子的药物递送系统协同增强自噬、抗炎和抗氧化治疗阿尔茨海默症 2025-02-11
