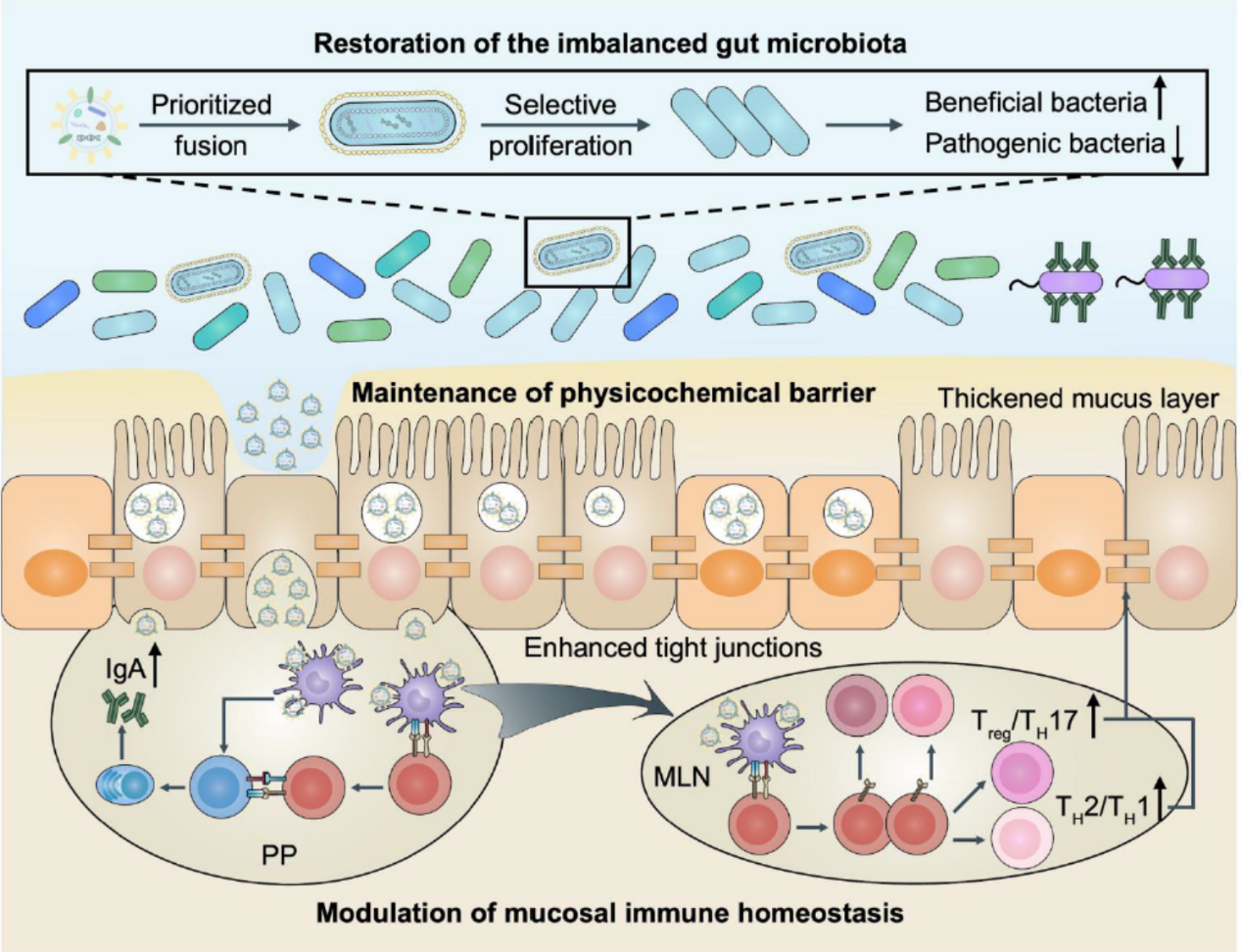
肠道菌群对肠道的免疫调节和健康维持起着极其重要的作用,而大多数肠道共生菌在增殖过程中会释放大量的外膜囊泡(OMV)。OMV是一种双层膜纳米结构,大小在20至400 nm之间,具备亲代细菌的多种有效成分,如核酸、蛋白质、酶和脂多糖等。那么这些最具细菌特征的纳米结构在干预肠道疾病中究竟扮演着什么样的重要角色?
近日,刘尽尧团队发现肠道共生菌衍生的OMV可以通过调节肠道微生物群、黏膜免疫和物理化学屏障的互补互惠多方面干预和改善肠道相关疾病。该团队以肠道阿克曼菌(Akkermansia muciniphila)为例,证明了口服递送共生菌衍生的OMV可以显著改善小鼠结肠炎的症状和病理变化,也能显著增强结直肠癌对PD-1免疫疗法的敏感度。作者揭示了OMV对不同疾病的显著疗效主要基于其对肠道稳态的调节,并证明了共生菌衍生的OMV通过选择性膜融合方式特异性促进有益菌的增殖(包括抑制炎症的共生细菌和恢复PD-1/PD-L1阻断结直肠疗效相关的有益细菌),进而抑制条件致病菌的扩增,恢复肠道微生物群的平衡。与此同时,OMV通过转移至Peyer斑块中并激活B细胞和树突状细胞引发黏膜免疫球蛋白A反应,维持免疫稳态并消除过度炎症反应,从而驱逐致病菌。此外,OMV还可进入肠上皮细胞并刺激紧密连接和黏液的表达维持肠屏障完整性。
与容易遭受环境破坏因素(包括胃酸、胆盐和胃肠道黏液)的活细菌相比,肠道共生菌衍生的OMV对这些刺激源具有较好的抵抗性,并且可通过直接的细胞-细胞相互作用与宿主互作,从而发挥出强有力的治疗效果。同时,考虑到粪菌移植临床应用的安全性问题, OMV在这些疾病治疗中的成功运用凸显了肠道微生物群衍生囊泡替代粪菌移植的潜力。
相关工作以“Versatility of bacterial outer membrane vesicles in regulating intestinal homeostasis”为题发表于Science Advances,博士生王馨悦为第一作者,刘尽尧研究员为通讯作者。该工作得到科技部重点研发计划课题、国家自然科学基金委面上项目、上海市探索者计划等支持。
论文链接:https://www.science.org/doi/10.1126/sciadv.ade5079
- 华东理工刘润辉教授、叶邦策教授 AHM:新型口服递送系统包封智能工程菌用于炎症性肠病治疗 2024-12-20
- 清华大学张明君教授和徐静副教授团队 Sci. Adv.:肠驱动仿生微针机器人用于生物类药物无痛口服递送 2024-01-11
- 浙江大学周民团队《ACS Nano》:微藻-胰岛素复合口服递送系统 2023-07-07
- 四川大学杨佼佼、梁坤能 Adv. Sci.:“排除异己”的植入体涂层 - 个性化定制细菌外膜囊泡实现选择性抗菌 2024-08-24
- 西南交大周绍兵教授、郭星教授团队 《Adv. Mater.》:细菌外膜囊泡搭乘中性粒细胞增强缺血性脑卒中治疗 2023-08-01
- 西南交大周绍兵教授团队《Adv. Mater.》:基于细菌外膜囊泡的肿瘤免疫治疗的研究取得了新进展 2021-12-09
- 上海交大刘尽尧团队《Sci. Adv.》:给益生菌穿着穿透型外衣,守护肠道稳态! 2021-05-17
