肿瘤射频消融治疗(Radiofrequency ablation, RFA)是目前临床上使用最为广泛的一种微创的局部肿瘤消融技术,目前在我国已经成为继手术切除、介入治疗后的第三大肝癌治疗手段。另外,局部射频消融治疗后坏死的肿瘤组织会释放肿瘤相关抗原,通过被抗原呈递细胞识别吞噬,而能够激活机体的免疫系统产生特异性的抗肿瘤免疫反应。但是,单独的射频消融治疗引起的抗肿瘤免疫反应水平一般较弱,且受射频电极针消融范围的限制,临床射频消融治疗目前仅对最大直径≤5cm的单发肿瘤或者最大直径≤3cm、数量≤3个的多发肿瘤有效;一旦肿瘤体积过大或者数量过多,一次完全消融肿瘤的几率明显降低,残瘤率和复发率均明显升高。因此,发展新型辅助策略以通过“局部肿瘤破坏与全身免疫系统激活”协同起效的方式来抑制肿瘤生长,实现局部消融治疗与全省免疫治疗的有机整合,具有重要的意义与临床实践价值。
鉴于多不饱和脂肪酸在脂肪氧化酶与亚铁离子的作用来能够发生脂质过氧化反应,他们利用碳酸钙辅助的双微乳法,将脂肪氧化酶和血红素共同包覆于PLGA纳米颗粒内以构建肿瘤微酸响应性纳米反应器,之后利用粘附性水凝胶将其固定在经RFA部分消融的残余肿瘤内。在肿瘤微酸环境的刺激下,该纳米反应器将逐步释放脂肪氧化酶和血红素,催化肿瘤残渣内的多不饱和脂肪酸发生脂质过氧化反应以诱导残余肿瘤细胞发生铁凋亡,进而通过这种“以瘤抑瘤”的策略有效提高了RFA对多种肿瘤模型的局部消融效果;同时,残余肿瘤细胞发生铁凋亡后会释放一系列危险信号分子(如:CRT, HMGB1)来招募树突状细胞(dendritic cells, DCs)以触发体内的特异性抗肿瘤免疫反应,并在免疫检查点阻断抗体(anti-PD-1)的协同作用下高效防止肿瘤复发与转移(图1)。

图1. 本研究的示意图。
利用脂质过氧化荧光探针发现该纳米反应器在弱酸性条件能够触发高效的脂质过氧化反应(图2a,b),进而诱导肿瘤细胞内脂质自由基水平提高(图2c,d),并发生铁凋亡(图2e-h)和促进CRT、HMGB1等危险信号分子释放(图2i)。

图2. 纳米反应器以肿瘤残渣为原料,触发癌细胞发生铁凋亡。
接下来,建立多种部分消融的肿瘤模型,发现利用粘附性水凝胶将该杀伤性纳米反应器固定在肿瘤部位后能够通过诱导脂质自由基的产生来高效抑制残余肿瘤的生长(图3)。
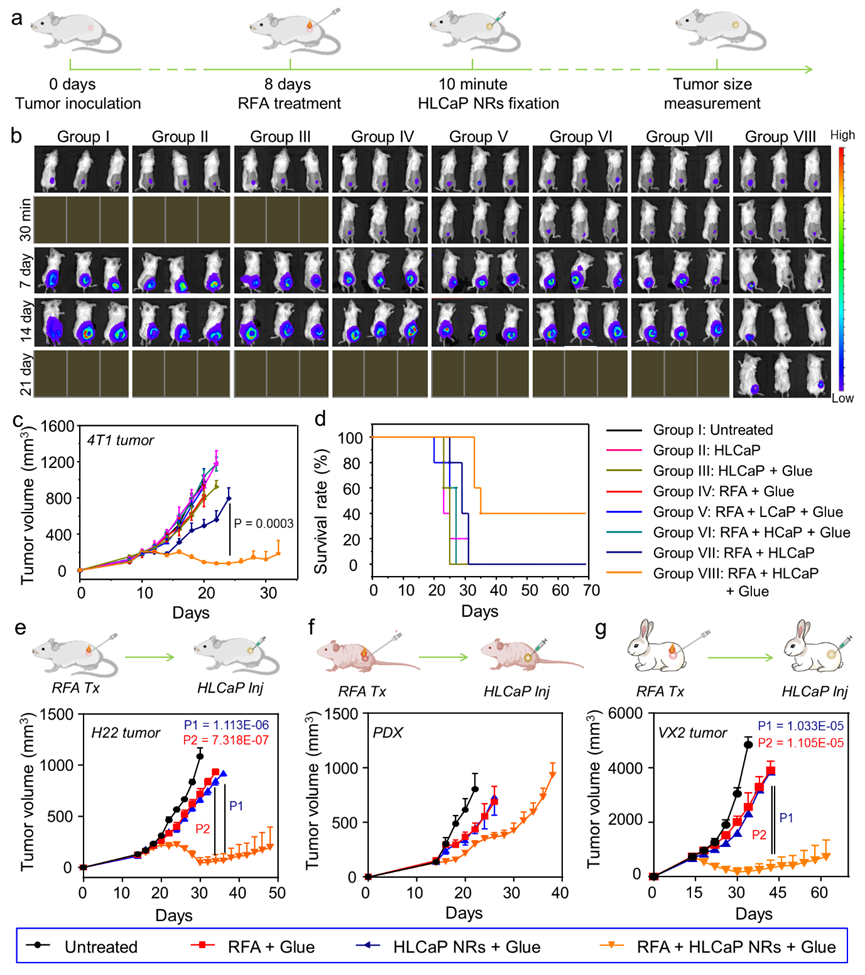
图3. 杀伤性纳米反应器能够有效抑制部分消融的小鼠4T1肿瘤、H22肿瘤、PDX肿瘤以及兔子VX2肿瘤的生长。
进一步研究发现,局部固定的杀伤性纳米反应其能够协同anti-PD-1疗法诱导机体产生高效的抗肿瘤免疫反应,进而高效抑制局部残余肿瘤和远端转移瘤的生长。

图4. 杀伤性纳米反应器联合anti-PD-1免疫疗法高效抑制肿瘤局部复发与转移。
以上成果以“Tumor-killing nanoreactors fueled by tumor debris can enhance radiofrequency ablation therapy and boost antitumor immune responses”为题发表在Nature Communications (2021, 12, 4299)上。论文的第一作者为苏州大学功能纳米与软物质研究院的博士研究生杨志娟,通讯作者为刘庄教授和冯良珠副研究员。
论文链接:https://www.nature.com/articles/s41467-021-24604-9
- 北京化工大学蔡晴/喻盈捷 AFM:三重生物粘附性微球赋能金属离子工程化外泌体疗法,实现血管化骨再生 2026-02-18
- 南京林业大学杨蕊副教授 Carbohyd. Polym.:木基高强度粘附性导电水凝胶用于柔性传感器 2025-09-28
- 苏大钟志远/邓超、苏大附一院朱晓黎 Nat. Commun.:肿瘤血管适应性、粘附性和可吸收性微球用于可持续的经动脉化学栓塞治疗 2025-07-09
- 兰州大学唐瑜、吕少瑜 Adv. Mater.:有机亚稳室温磷光水凝胶 2026-02-21
- 南京理工傅佳骏/姚博文团队 Nat. Commun.:类神经、导电通路可重构的水凝胶基一体化电子电路用于人-机整合 2026-02-14
- 华科大罗志强教授团队《Nat. Commun.》:可注射导电水凝胶实现无线、微创深部脑神经调控 2026-02-10
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
