近日,金宁一院士和黄宇彬教授团队利用原位给药策略,构建了具有药物缓释功能的多层载药纤维毡,结合快中子照射,实现了前后夹击,用于恶性肝癌的治疗。文章以“The associated killing of hepatoma cells using multilayer drugloaded mats combined with fast neutron therapy”为题发表在Nano Research上。
2020年3月11日,全球首个AB-BNCT系统(住友重机械工业的BNCT治疗系统NeuCure?与BNCT剂量计算程序NeuCure?Dose Engine) 正式在日本获批上市。2020年3月25日,厚生劳动省批准了硼药物Steboronine®;日本南东北综合医院BNCT研究中心已治疗患者500多例,完成二期临床,2020年6月正式面向全球招募不可手术切除的局部晚期或复发性头颈癌国际患者。2020年8月13日,中国科学院高能物理研究所宣布,成功研制我国首台自主研发加速器硼中子俘获治疗(下称BNCT)实验装置,目前已启动首轮细胞实验和小动物实验,为开展临床试验做前期技术准备,且有望在4年内完成临床实验,走向市场。
为了便于临床转化,金宁一院士和黄宇彬教授团队自2015年开始,针对中子俘获治疗肿瘤中存在着中子源和硼药的递送两个难题,进行了针对性的设计,首先构建了可应用于生物医疗的小型化直线加速器中子装置(Appl. Radiat. Isotopes 2020, 160, 109138),该装置具有中子纯度高,造价低,适合于基础科研等优点,可通过装置进行快中子肿瘤治疗和硼中子俘获治疗(BNCT)。该团队将碳硼烷修饰到碳酸酯单体,精确控制硼含量并进行聚乙二醇修饰,构建两亲性生物可降解的富硼聚合物,该聚合物具有良好的BNCT效果,是一种有应用前景的癌症硼载体(Bioconjugate Chemistry 2016,27, 2214-2223)。
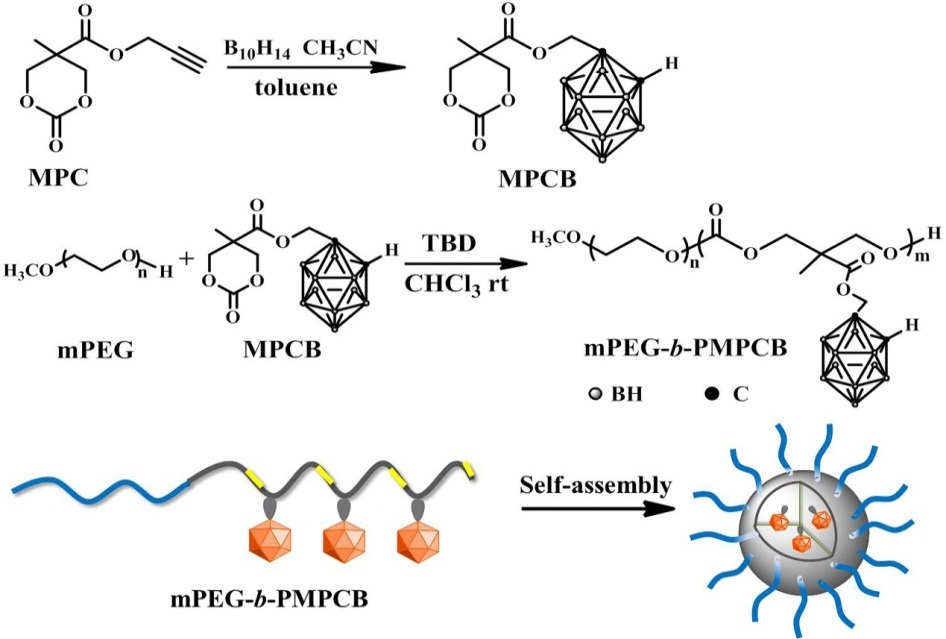
图1 mPEG-b-PMPCB的合成和组装示意图
而在快中子治疗(FNT)领域,由于FNT是一种高度线性的能量传递,在肿瘤治疗中优于常规放疗的技术,具有更高的相对生物学效应,对细胞周期的依赖性较弱。临床试验数据显示,FNT改善了唾液腺恶性肿瘤和高危软组织肉瘤的局部控制。该团队利用二氯乙酸(DCA)可以逆转Warburg效应的特性,以此来降低肿瘤细胞的能量供应,造成肿瘤细胞的能量耗竭,从而可以利用较低的中子剂量实现肿瘤细胞的凋亡,因此DCA可以作为FNT等放疗的增敏剂。再进一步的研究中,金宁一院士和黄宇彬教授团队的科研人员合作,利用纤维毡载药技术及化学改性手段控制药物释放,通过构建了不同结构形式的DCA衍生物(Ion-DCA)和(Co-DCA),以聚乳酸(PLA)作为纤维载体,将DCA及衍生物载入夹层式载药纤维毡,该纤维毡能够黏附在皮下和原位肿瘤模型的肿瘤表面,在原位释放,进而调节细胞内代谢促进肿瘤细胞凋亡。此时,低剂量FNT在肿瘤部位照射,进一步提高肿瘤细胞的凋亡水平,实现FNT与化疗联合抑制肿瘤的目的。
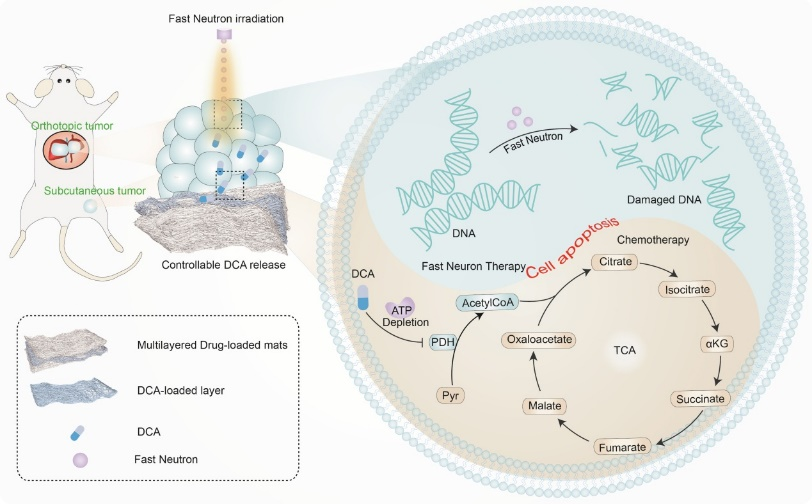
图2基于多层载药纤维毡和快中子治疗(FNT)的协同化疗对小鼠皮下和原位肝肿瘤的治疗机制(TCA:三羧酸循环,PDH:丙酮酸脱氢酶)。
研究人员还构建了小鼠肝癌的皮下模型和原位模型来评价治疗效果,结果表明,原位给药策略能够很好的控制药物式样,结合FNT后,该策略具有非常好的肿瘤抑制效果(图3),是一种非常有前景的肿瘤治疗策略。
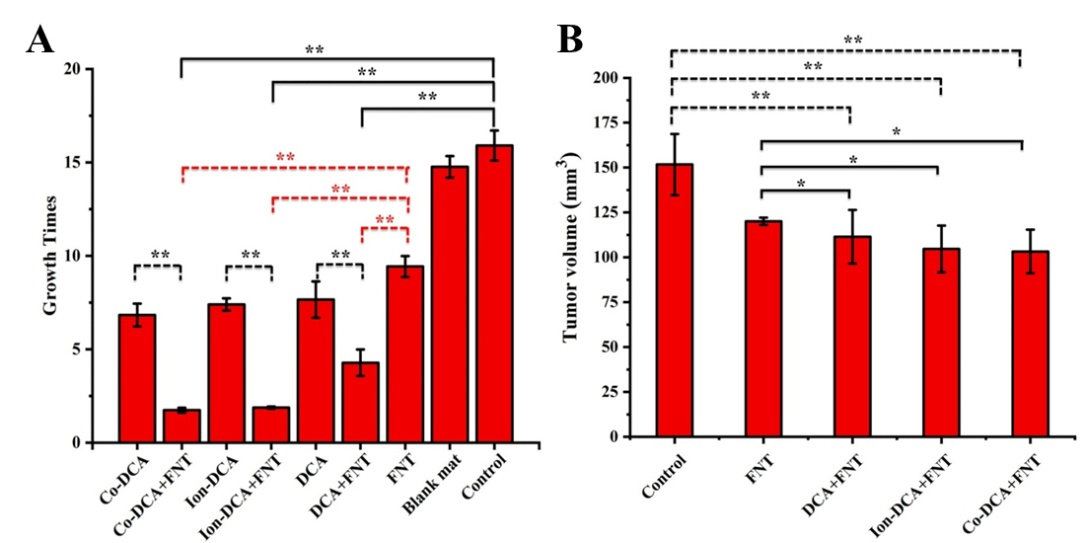
图3 (A)H22皮下肝癌模型各组肿瘤增长;(B)H22原位肝癌模型肝及肿瘤体积
该工作得到了国家自然基金支持。
原文链接:https://doi.org/10.1007/s12274-020-3113-1
- 苏大李刚、附一院李峰和附四院沈罡 IJBM: 兼具抗菌和抗狭窄功能的载药可降解输尿管支架 2025-06-29
- 上海交大庞燕团队 Sci. Adv.:原位“两面神”载药涂层 可实现持久舒适的眼表给药 2025-03-13
- 川大李旭东/陈君泽、港城大谭超良团队 Adv. Mater.: 多酚-氨基酸缩合物库用于超高载药量纳米药物的高通量连续流生产 2025-02-12
- 武汉纺织大学徐卫林/刘欣/吕佩 AFM:具有超强自持表面静电力的抗菌聚酰亚胺纤维毡实现高效空气过滤 2024-03-06
- 河工大苑文静副研究员课题组:MXene/聚合物纤维毡用于超高灵敏度、宽传感范围的柔性多功能应变传感器 2019-05-20
- 西安交大吴道澄团队 ACS Nano:分子堆砌@无限配位聚合物复合纳米粒实现肿瘤连续高强度光热-热动力交替循环治疗和化疗 2025-08-01
- 巴黎高科化学学院李敏慧教授与合作者 JACS: 创新型“类酶”纳米材料 → 饿死癌细胞 2025-07-20
